Vandenilio izotopai: protiumas (1H), deuteris (2H) ir tritis (3H)
Sužinokite apie vandenilio izotopus — protiumą (1H), deuterį (2H) ir radioaktyvų tritį (3H): savybės, taikymai ir skirtumai viename aiškiame vadove.
Vandenilis turi tris pagrindinius izotopus: protiumą (1H), deuterį (2H) ir tritį (3H). Šie izotopai natūraliai susidaro gamtoje. Protiumas ir deuteris yra stabilūs, o tritis yra radioaktyvus — jo pusėjimo trukmė yra apie 12,32 metų. Mokslininkai laboratorijose yra sukūrę ir dar keturis vandenilio izotopus (4H–7H), tačiau šie izotopai yra labai nestabilūs ir natūraliai neegzistuoja.
Pagrindinės savybės ir skirtumai
Visi trys pagrindiniai izotopai turi po vieną protoną, bet skiriasi neutronų skaičiumi:
- Protiumas (1H) neturi neutrono — tai įprastas, dažniausiai sutinkamas vandenilis.
- Deuteris (2H, dažnai žymimas D) turi vieną neutroną; dėl didesnės masės jo cheminės ir fizikinės savybės šiek tiek skiriasi nuo protiumo (pvz., lėtesni cheminiai procesai — vadinamasis izotopinis kinetinis efektas).
- Tritis (3H, arba T) turi du neutronus ir yra radioaktyvus — skleidžia žemo energijos β spinduliuotę.
Natūralus paplitimas
Protiumas yra absoliuti dauguma visose natūraliuose vandenilio šaltiniuose. Deuterio koncentracija gamtoje yra labai maža, tačiau pakankama, kad būtų naudojama pramonėje ir moksliniuose tyrimuose — deuterio santykis vandens molekulėse paprastai siekia maždaug ~0,015 % (apie 150–160 ppm). Tritis gamtoje randamas tik labai mažais kiekiais — jis susidaro veikiamas kosminių spindulių atmosferoje arba branduoliniuose procesuose, o komerciškai gaminamas reaktoriuose ir ciklotronuose.
Gamyba ir šaltiniai
Deuteris komerciškai išgaunamas skirtingais metodais: frakcinė distiliacija, elektrolizė ir specialūs procesai (pvz., Girdlerio sūro sulfido procesas) naudojami sunkiesiems vandenims (D2O) gaminti. Tritis dažniausiai gaunamas neutronų sąveikoje su lengvaisiais elementais (pavyzdžiui, su Li) arba tiesiogiai gaminamas sintezės įrenginiuose bei branduolinėse jėgainėse.
Praktinis panaudojimas
- Deuteris (D): naudojamas kaip izotopinis žymeklis biologijoje ir chemijoje, deuteruoti tirpikliai yra įprasti NMR (branduolių magnetinio rezonanso) matavimuose, sunkusis vanduo (D2O) naudojamas tam tikruose reaktoriuose kaip moderatorius ir aušinimo skystis, taip pat deuteris svarbus izotopų tyrimuose ir spektroskopijoje.
- Tritis (T): naudojamas kaip radioaktyvus žymeklis, pramoniniuose ir moksliniuose eksperimentuose, taip pat jis yra vienas pagrindinių kuro izotopų termobranduolinėje sintezėje (DT sintezė), kurioje T reaguoja su deuteriu, išskirdamas didelį kiekį energijos.
- Protiumas yra įprastinė vandenilio forma, naudojama pramonėje, chemijoje, energetikoje ir t. t.
Saugumas ir biologinis poveikis
Tritis skleidžia žemo energijos β daleles, kurios išorėje praeina vos kelis milimetrais oro arba yra užblokuojamos plonu stiklu — pagrindinė rizika kyla, jei tritis patenka į organizmą (per orą, vandenį ar maistą). Tokiu atveju jis gali sukelti radiacinę žalą vidiniams audiniams. Deuteris pats savaime nėra radioaktyvus, tačiau dideli sunkiojo vandens kiekiai organizme (kai D2O pakeičia daugumą įprasto vandens) gali sutrikdyti ląstelių dalijimąsi ir metabolinius procesus; toks poveikis pasireiškia tik itin didelėse koncentracijose, ne kasdieninėse aplinkybėse.
Pavadinimai ir nomenklatūra
Pagrindiniai vandenilio izotopai yra unikalūs tuo, kad turi savus pavadinimus. Šie vardai vartojami kasdienėje mokslinėje ir techninėje kalboje. Deuteris ir tritis dažnai žymimi simboliais D ir T. Vis dėlto Tarptautinė teorinės ir taikomosios chemijos sąjunga (IUPAC) rekomenduoja naudoti izotopinę žymėjimo formą (2H, 3H ir pan.), nors trumpieji simboliai D ir T išlieka plačiai paplitę ir praktiški.
Istorija trumpai
Deuteris buvo atrastas 1931 m. (Haroldas Urey ir bendradarbiai), o tritis — 1930–1934 m. laikotarpiu laboratorinėse sąlygose (dalyvaujant tokiems mokslininkams kaip Rutherfordas, Oliphantas ir kt.). Vėlesni metai atnešė ir trumpalaikius izotopus (4H–7H), kuriuos pavyko susintetinti branduolinių reakcijų metu; jų gyvavimo laikas yra itin trumpas — jie greitai suyra.
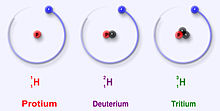
Trys stabiliausi vandenilio izotopai
Protas (vandenilis-1)
Protiumas yra labiausiai paplitęs vandenilio izotopas. Jis sudaro daugiau kaip 99,98 % viso visatoje esančio vandenilio. Jis pavadintas protu, nes jo branduolyje yra tik vienas protonas. Pročio atominė masė yra 1,00782504(7) u. Pročio simbolis yra 1H.Stebint protonas niekada nesuiro, todėl mokslininkai mano, kad protimas yra stabilus izotopas. Naujosios dalelių fizikos teorijos numato, kad protonas gali suirti, tačiau šis skilimas yra labai lėtas. Teigiama, kad protono pusėjimo trukmė yra 1036 metų. Jei protono skilimas yra tiesa, tai visi kiti branduoliai, apie kuriuos sakoma, kad jie yra stabilūs, iš tikrųjų yra stabilūs tik stebimuoju požiūriu, t. y. atrodo, kad jie yra stabilūs. Neseniai atlikti eksperimentai parodė, kad jei protonų skilimas iš tiesų vyksta, jų pusėjimo trukmė būtų 6,6 × 10 33metų.
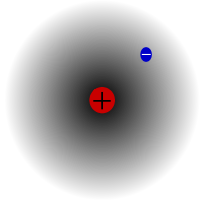
Protiumas - labiausiai paplitęs vandenilio izotopas. Jis ypatingas tuo, kad yra vienintelis izotopas, neturintis neutrono.
Deuteris (vandenilis-2)
Deuteris, arba 2H, kartais D, yra dar vienas stabilus vandenilio izotopas. Šis izotopas turi vieną protoną ir vieną neutroną. Jis sudaro apie 0,0026-0,0184 % visų Žemėje esančių vandenilio atomų. Vandenilio dujose Žemėje deuterio yra mažiau, daugiau jo yra jūros vandenyje (0,015 % arba 150 ppm). Deuteris nėra radioaktyvus ir nekenkia gyvoms būtybėms. Deuteris taip pat gali sudaryti vandens molekules. Vanduo, turintis deuterio, o ne protio, vadinamas sunkiuoju vandeniu.
Tritis (vandenilis-3)
Tritis (3H) yra stabiliausias vandenilio radioizotopas. Tai reiškia, kad iš visų radioaktyviųjų vandenilio izotopų tritis yra mažiausiai radioaktyvus. Jo branduolyje yra protonas ir 2 neutronai. Tritis skyla beta minus skilimo būdu ir virsta heliu-3. Jo pusėjimo trukmė yra 12,32 metų.Tritis natūraliai susidaro dėl viršutinių atmosferos sluoksnių dujų ir kosminių spindulių sąveikos. Jis taip pat susidaro per branduolinių ginklų bandymus. Tritis ir deuteris naudojami D-T branduolių sintezėje žvaigždėse, kad išsiskirtų daug energijos.
Klausimai ir atsakymai
K: Kiek yra pagrindinių vandenilio izotopų?
Atsakymas: Yra trys pagrindiniai vandenilio izotopai: protas, deuteris ir tricis.
K: Ar protio ir deuterio izotopai yra stabilūs?
A: Taip, protiumas ir deuteris yra stabilūs izotopai.
K: Koks yra tričio pusėjimo laikas?
A: Tritis yra radioaktyvus, jo pusėjimo trukmė yra apie 12 metų.
K: Kiek dar vandenilio izotopų yra sukūrę mokslininkai?
A: Mokslininkai sukūrė keturis kitus vandenilio izotopus: nuo 4H iki 7H.
K: Ar šie keturi papildomi vandenilio izotopai egzistuoja natūraliai?
Atsakymas: Ne, šie izotopai yra labai nestabilūs ir natūraliai neegzistuoja.
K: Kuo unikalūs pagrindiniai vandenilio izotopai?
A: Pagrindiniai vandenilio izotopai yra unikalūs, nes jie vieninteliai turi pavadinimą.
K: Ar deuteris ir tricis turi savo simbolius?
A: Taip, deuteris ir tricis kartais turi savo simbolius: Tačiau Tarptautinė teorinės ir taikomosios chemijos sąjunga nelabai mėgsta šiuos pavadinimus, nors jie dažnai vartojami.
Ieškoti