Izotopai: apibrėžimas, savybės ir svarba chemijoje
Izotopai: aiškus apibrėžimas, savybės ir chemijos reikšmė — masės skirtumai, masės efektas, cheminės reakcijos ir praktiniai pavyzdžiai. Sužinokite daugiau.
Cheminio elemento atomai gali egzistuoti kaip skirtingi tipai — jie vadinami izotopais. Izotopai turi tą patį protonų (elektronų) skaičių, bet skiriasi neutronų skaičiumi. Dėl to skirtingi to paties elemento izotopai turi skirtingas mases: masė reiškia, kiek medžiagos yra ore ar objekte. Kadangi neutronų skaičius keičiasi, ne visi izotopai sveria vienodai ir turi vienodą masės skaičių.
Sąvoka ir žymėjimas
Skirtingų to paties elemento izotopų atominis skaičius yra tas pats — jie turi vienodą protonų skaičių, nes atominį numerį lemia protonų kiekis. Tačiau izotopai skiriasi masės skaičiumi, nes neutronų kiekis branduolyje yra įvairus. Izotopą dažnai žymima masa priešais cheminio elemento simbolį, pavyzdžiui, 12C, 13C arba 14C; taip pat sutinkama žymė A/Z X (A — masės skaičius, Z — protonų skaičius).
Elektroninė sandara ir cheminės savybės
Neutraliame atome elektronų skaičius sutampa su protonų skaičiumi. Todėl to paties elemento izotopai turi tokią pačią elektroninę konfigūraciją ir todėl cheminiu požiūriu elgiasi labai panašiai. Vis dėlto fizinės savybės, pavyzdžiui, masė ar tankis, skiriasi, o tai gali paveikti reakcijų greitį ir kinetiką.
Masės efektas ir kinetinis izotopų efektas
Sunkesni izotopai paprastai cheminėse reakcijose reaguoja šiek tiek lėčiau už lengvesnius — tai vadinama masės efektu arba kinetiniu izotopų efektu. Šis poveikis yra itin ryškus vandenilio izotopams: protui (1H) ir deuteriui (2H), nes deuterio masė yra maždaug dvigubai didesnė už proto masę. Dėl to reakcijų, kurių metu išardomas arba formuojamas vandenilio cheminis ryšys, greičiai gali skirtis žymiai. Tuo tarpu sunkesnių elementų izotopų santykinės masės skirtumai yra mažesni, todėl masės poveikis cheminėms reakcijoms dažniausiai būna menkesnis.
Stabilumas, radioaktyvumas ir natūralūs izotopai
Izotopai gali būti stabilūs arba radioaktyvūs. Stabilūs izotopai išlieka nepakitę ilgame laikotarpyje, o radioaktyvūs izotopai savaime suyra emisijos būdu (alfa, beta, gama), paversdami vienus elementus kitais. Pavyzdys — anglies izotopai: 12C ir 13C yra stabilūs, o 14C yra radioaktyvus ir naudojamas radiokarboniniam datavimui. Periodinės lentelės vieta ir izotopų savybės yra glaudžiai susijusios su elementų padėtimi periodinės elementų lentelės tinkle.
Izotopų pasiskirstymas ir vidutinė atominė masė
Gamtoje dauguma elementų sudaryti iš kelių izotopų mišinio. Kiekvieno izotopo santykinė gausa lemia cheminio elemento santyvinę atominę masę, kurią mes matome cheminių elementų lentelėje (tai yra vidutinė masė pagal izotopų santykinį paplitimą). Izotopinė gausa gali kisti priklausomai nuo šaltinio — dėl to gali atsirasti izotopų frakcijavimas, svarbus geochemijoje ir paleoklimatologijoje.
Pritaikymas ir praktinė reikšmė
- Radiodatavimas: 14C naudojamas organinių medžiagų amžiui nustatyti.
- Medicinos diagnostika: radioaktyvūs izotopai (pvz., technetas-99m) taikomi vaizdams gauti ir organų funkcijai tirti.
- Pramonė ir energetika: skilimo izotopai naudojami branduolinėje energetikoje bei kaip šaltiniai šilumai arba neutronams generuoti; sunkesnis vandenilis (deuteris) naudojamas kaip moderatorius (sunkus vanduo).
- Moksliniai tyrimai: izotopiniai žymekliai padeda sekti chemines reakcijas ir biologinius procesus (stebėjimas „tracer“ metodais).
- Ekologija ir geochemija: izotopų santykiai leidžia atsekti maisto grandinių šaltinius, vandens ciklą ir klimato pokyčius.
Santrauka
Izotopai — tai tos pačios cheminės rūšies atomai, turintys vienodą protonų (elektronų) skaičių, bet skirtingą neutronų kiekį, todėl skiriasi jų masės skaičiai ir fizinės savybės. Nors cheminės savybės dažnai būna labai panašios dėl tos pačios elektroninės struktūros, masės skirtumai sukelia reikšmingus efektus kai kuriuose procesuose — ypač kai lyginami izotopai su didele santykine mase, pvz., vandenilio atvejais. Izotopų tyrimai ir pritaikymas turi didelę reikšmę mokslui, medicinai ir pramonei.
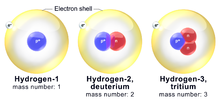
Vandenilio izotopai
Stabilumas
Atomo branduolį sudaro protonai ir neutronai, kuriuos tarpusavyje jungia branduolinė jėga.Kadangi protonai turi teigiamą krūvį, jie vienas kitą atstumia. Neutronai, kurie yra neutralūs, stabilizuoja branduolį. Kadangi jie yra branduolyje, protonai šiek tiek stumiami vienas nuo kito. Dėl to sumažėja elektrostatinis atstūmimas tarp protonų. Jie vis dar veikia vienas kitą ir protonus traukos branduolio jėga. Kad du ar daugiau protonų susijungtų į branduolį, reikia vieno ar daugiau neutronų. Didėjant protonų skaičiui, didėja ir neutronų, reikalingų stabiliam branduoliui sukurti, skaičius.
Gamtoje kai kurie elementai turi tik vieną izotopą. Pavyzdžiui, fluoras-19 (19F) yra vienintelis stabilus fluoro izotopas iš kelių. Kiti elementai turi daug izotopų. Pavyzdžiui, ksenonas turi 9 izotopus. Iš 81 elemento, turinčio stabilų izotopą, didžiausias bet kurio elemento stabilių izotopų skaičius yra dešimt (alavo elemento).
Kai kurie izotopai yra radioaktyvūs. Jie vadinami radioaktyviaisiais izotopais. Kiti nėra radioaktyvūs. Jie vadinami stabiliaisiais izotopais.
Vandenilis turi tris paplitusius izotopus. Labiausiai paplitęs vandenilio izotopas vadinamas protu (1H). Vandenilio atomas su papildomu neutronu (atominė masė 2) vadinamas deuteriu (2H). Vandenilis, turintis vieną protoną ir du neutronus (atomo masė 3), vadinamas tričiu (3H). Protas ir deuteris yra stabilūs izotopai, o tritis - radioaktyvus izotopas.
Visi sunkiausi periodinės elementų lentelės elementai yra radioaktyvūs. Visi radono, torio ir urano izotopai yra radioaktyvūs, nes yra labai sunkūs. Taip yra todėl, kad atomo branduolio viduje esančios branduolinės jėgos sunkiai sulaiko visas daleles, kuriose yra tiek daug protonų ir neutronų.
Susiję puslapiai
- Izotopų elektrochemija
Klausimai ir atsakymai
K: Kas yra izotopai?
A: Izotopai - tai skirtingos cheminio elemento atomų rūšys, kurios pasižymi labai panašiomis savybėmis, tačiau sveria skirtingus kiekius.
K: Kuo izotopai skiriasi vienas nuo kito?
A: To paties elemento atomai turi vienodą protonų skaičių, tačiau skirtingi izotopai turi skirtingą neutronų skaičių. Dėl to skiriasi ir jų masės skaičius, kuris yra protonų skaičius plius neutronų skaičius.
K: Ar visi izotopai yra stabilūs?
Atsakymas: Ne, kai kurie izotopai nėra stabilūs, todėl radioaktyvaus skilimo būdu jie virsta kitu izotopu arba elementu. Tokie izotopai vadinami radioaktyviaisiais, o kiti, kurie nėra radioaktyvūs, vadinami stabiliaisiais izotopais.
K: Kaip galima nustatyti izotopą?
A: Izotopas paprastai įvardijamas nurodant elementą ir jo masės numerį. Pavyzdžiui, anglis-12 arba 12C yra atomas, turintis 6 protonus ir 6 neutronus, o anglis-14 arba 14C turi 8 neutronus.
K: Ką reiškia "izotopas"?
A: Žodis "izotopas" reiškia "esantis toje pačioje vietoje" ir reiškia, kad visi to paties elemento atomai yra toje pačioje periodinės elementų lentelės vietoje.
K: Kodėl atomai, turintys daugiau neutronų, sveria daugiau nei tie, kurie turi mažiau neutronų?
A: Atomai, turintys daugiau neutronų, sveria daugiau, nes juose yra papildomų dalelių (neutronų), kurios padidina jų bendrą masę, palyginti su atomų, turinčių mažiau neutronų, mase.
Ieškoti