Periodinė cheminių elementų lentelė — apibrėžimas, struktūra ir istorija
Atraskite periodinę cheminių elementų lentelę: apibrėžimas, struktūra, periodai, grupės ir istorija nuo Mendelejevo iki šiandienos IUPAC pokyčių.
Periodinė cheminių elementų lentelė - tai žinomų cheminių elementų sąrašas. Lentelėje elementai išdėstyti pagal jų atominius numerius, pradedant mažiausiu vienetu - vandeniliu. Elemento atominis numeris yra toks pat kaip protonų skaičius tame konkrečiame atomo branduolyje. Periodinėje lentelėje elementai suskirstyti į periodus ir grupes. Elementų eilutė visoje lentelėje vadinama periodu. Kiekvienas periodas turi savo numerį; nuo 1 iki 8. 1 periode yra tik 2 elementai: vandenilis ir helis. 2 ir 3 periodai turi po 8 elementus. Kiti periodai yra ilgesni. Periodo elementai turi iš eilės einančius atominius numerius.
Lentelės elementų stulpelis vadinamas grupe. Standartinėje periodinėje lentelėje yra 18 grupių. Kiekviena grupė turi numerį: nuo 1 iki 18. Grupės elementų elektronai išsidėstę panašiai, pagal valentingumo elektronų skaičių, todėl jie pasižymi panašiomis cheminėmis savybėmis (elgiasi panašiai). Pavyzdžiui, 18 grupė vadinama tauriosiomis dujomis, nes visos jos yra dujos ir nesijungia su kitais atomais.
Egzistuoja dvi grupių numerių sistemos: arabiškais skaitmenimis (1, 2, 3) ir romėniškais skaitmenimis (I, II, III). Romėniški skaitmenys buvo naudojami didžiąją XX a. dalį. 1990 m. Tarptautinė teorinės ir taikomosios chemijos sąjunga (IUPAC) nusprendė naudoti naują sistemą su arabiškais skaitmenimis ir pakeisti dvi senąsias grupių pavadinimų sistemas, kuriose buvo naudojami romėniški skaitmenys.
Periodinę lentelę chemikai naudojo norėdami pastebėti dėsningumus ir ryšius tarp elementų. Periodinėje lentelėje yra trys pagrindinės grupės: metalai, metaloidai ir nemetalai. Pavyzdžiui, lentelės apačioje ir kairėje esantys elementai yra metalingiausi, o viršuje dešinėje esantys elementai yra mažiausiai metalingi. (pvz., cezis yra daug metalingesnis už helį). Taip pat yra daug kitų dėsningumų ir ryšių.
Periodinę lentelę išrado rusų chemikas Dmitrijus IvanovičiusMendelejevas (1834-1907). Jo garbei 101 elementas pavadintas jo vardu - mendelejevas.
Struktūra ir blokai
Periodinė lentelė nėra tik elementų sąrašas — ji atspindi elektronų sluoksnių užpildymą. Elementai suskirstyti į keturis pagrindinius elektroniškus blokus: s, p, d ir f blokus, kurie atitinka paskutinio užpildomo orbitinės energijos tipo elektronus. Iš čia kyla ir periodų ilgiai: 1 periodą sudaro 2 elementai (s-blokas), 2 ir 3 periodus — po 8 elementus (s + p), 4 ir 5 periodai — po 18 elementų (s + d + p), o 6 ir 7 — po 32 elementus (įskaitant f bloką: lantanoidus ir aktinoidus).
Periodiniai dėsningumai ir savybės
Periodinė lentelė leidžia prognozuoti ir aiškinti medžiagų savybes. Svarbiausi dėsningumai:
- Atominis skersmuo: didėja einant žemyn grupėje (dėl papildomų sluoksnių) ir mažėja einant iš kairės į dešinę per periodą (didesnė branduolio trauka iš lygio į lygį).
- Jonizacijos energija: paprastai didėja iš kairės į dešinę per periodą ir mažėja žemyn grupėje.
- Elektronegatyvumas: didėja iš kairės į dešinę ir mažėja žemyn; tai matas, kaip stipriai atomas pritraukia elektronus cheminėse jungtyse.
- Metališkumas: didėja žemyn ir kairėje — elementai apačioje kairėje yra labiausiai metaliniai.
Grupės ir jų pavadinimai
Be skaičių, kai kurios grupės turi tradicinius pavadinimus, kurie yra plačiai vartojami:
- 1 grupė: alkaliniai metalai (išskyrus vandenilį dažnai priskiriamas atskirai)
- 2 grupė: žemės rūgščių metalai (arba alkaliažemiai metalai)
- 17 grupė: halogenai — labai reaktyvūs nemetalai
- 18 grupė: tauriosios dujos — nereaktyvūs elementai
Istorija ir reikšmė
Periodinės lentelės idėja vystėsi ilgą laiką. Mendelejevas sudarė pirmą praktinę lentelę 1869 m., kai pastebėjo, kad elementai, išdėstyti pagal didėjantį atomų masę (tuo metu dar nebuvo žinomas atominis numeris), rodo periodinius panašumus. Jis netgi prognozavo tuomet nežinomų elementų savybes ir paliko tuščias vietas – vėliau atradus šiuos elementus, jo prognozės pasitvirtino. Šiuolaikinė lentelė remiasi atominiais skaičiais (protonų skaičiumi), o ne atomine mase, kas paaiškėjo po branduolio ir elektronų sandaros supratimo.
Izotopai, stabilumas ir sintetiniai elementai
Elementas apibrėžiamas protonų skaičiumi, tačiau kiekvienas elementas gali turėti skirtingą neutronų skaičių — tai vadinama izotopais. Kai kurių elementų natūralios izotopų savybės lemia jų radioaktyvumą arba stabilumą. Daug naujų elementų (ypač >92, urano) buvo sintezuoti laboratorijose; jie gali turėti trumpą gyvavimo laiką ir specialias pavadinimų taisykles, kurias prižiūri IUPAC.
Praktinis panaudojimas ir svarba
Periodinė lentelė yra nepakeičiamas įrankis chemikams, fizikos mokslininkams, inžinieriams ir medicinos specialistams. Ji padeda:
- prognozuoti naujų junginių sudarymą ir reakcijų eigą,
- rinktis tinkamus elementus pramoniniams procesams (pvz., katalizatoriams, lydiniams),
- suprasti biologinius procesus, kuriuose dalyvauja metalai ir nemetaliai elementai,
- mokyti ir perteikti cheminių savybių dėsnius.
Santrauka
Periodinė cheminių elementų lentelė – tai sistemingas elementų išdėstymas, paremtas atomų sandara ir periodiniais dėsningumais. Ji leidžia suprasti ir prognozuoti cheminių elementų savybes, paaiškina medžiagų elgseną ir yra esminė šiuolaikinės chemijos bei susijusių mokslų dalis.
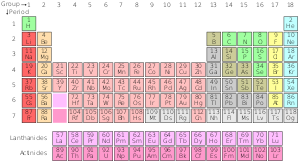
Standartinis periodinės lentelės variantas
Standartinė periodinė lentelė
| Grupė→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanidai | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinidai | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 eurų | *** Superaktinidai | |||||||||||||||||
| * Lantanidų serija | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Aktinidų serija | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superaktinidų serija | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ubė | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superaktinidų serija | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superaktinidų serija | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165 AGP | |||||
| *** Superaktinidų serija | 166Uhhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Naudojimas | 180Uon | |||||
| *** Superaktinidų serija | 181Jūs | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superaktinidų serija | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superaktinidų serija | 211Buu | 212Bub | 213Bet | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 mlrd. | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Periodinės lentelės cheminės serijos
- Šarminiai metalai
- Šarminės žemės
- Lantanidai
- Aktinidai
- Superaktinidai
- Pereinamojo laikotarpio metalai
- Prasti metalai
- Nemetalai
- Halogenai
Būklė esant standartinei temperatūrai ir slėgiui. Virš elemento simbolio esančio skaičiaus (atominio skaičiaus) spalva rodo elemento būseną normaliomis sąlygomis.
- mėlynai pažymėtos dujos
- žalia spalva pažymėti skysčiai
- juodos spalvos yra kietos.
- Tie, kurių ribos tvirtos, turi stabilius izotopus (pirmykščiai elementai).
- Tuose su brūkšniuotomis ribomis yra tik radioaktyviųjų gamtoje randamų izotopų.
- Taškeliais pažymėti elementai natūraliai nepasitaiko (sintetiniai elementai)
- tie, kurie neturi sienų, yra per daug radioaktyvūs, kad dar būtų atrasti.
Kiti cheminių elementų vaizdavimo būdai
Pirmiau pateikta periodinės lentelės versija yra dažniausiai naudojama. Kitos plačiai paplitusios versijos pateikiamos toliau:
· 
Teodoras Benfėjus elementus išdėstė spirale aplink vandenilį. Elemento padėtį lemia atominė masė.
· 
Dmitrijus Ivanovičius Mendelejevas naudojo gėlių išdėstymą; aktinidai, lantanidai pavaizduoti kaip kilpos šalia pagrindinės grupės.
· 
Timotiejus Stovėjus išdėstė elementus pagal kvantinį skaičių.
· ![]()
Bettermanas išdėstė elementus pagal jų izoelektrines savybes, kurias galima paversti polinomine forma.
· 
Trikampio formos versija pagal Zmaczynski ir Bayley
· 
Išdėstyti piramidės forma.
Mažiau naudojamos versijos
- Standartinėje lentelėje pateikiami pagrindiniai duomenys. Ji pateikta pirmiau
- Vertikali lentelė, užtikrinanti geresnį skaitomumą interneto naršyklėse
- Didžiojoje lentelėje pateikiami pagrindiniai duomenys ir išsamūs elementų pavadinimai
- Šioje didžiulėje lentelėje pateikiami pagrindiniai duomenys, taip pat išsamūs elementų pavadinimai ir atominės masės.
- Elektronų konfigūracijos
- Metalai ir ne metalai
- Elementų sąrašas: pavadinimas, simbolis, atominis skaičius, atominė masė, grupė ir periodas; galima rūšiuoti pagal bet kurį iš šių požymių.
- Elementų sąrašas pagal simbolį
- Elementų sąrašas pagal virimo temperatūrą
- Elementų sąrašas pagal lydymosi temperatūrą
- Elementų sąrašas pagal tankį
Susiję puslapiai
- Periodinės lentelės grupė
- Periodinės lentelės laikotarpis
- Išplėstinė periodinė lentelė
Klausimai ir atsakymai
K: Kas yra periodinė elementų lentelė?
A: Periodinė lentelė - tai lentelė, kurioje visi žinomi cheminiai elementai išdėstyti pagal jų atominius numerius, pradedant vandeniliu, kurio numeris vienas. Panašių savybių elementai dažnai išdėstomi šalia vienas kito.
K: Kiek periodų ir grupių yra standartinėje periodinėje lentelėje?
A: Standartinėje periodinėje lentelėje yra 8 periodai ir 18 grupių.
K: Ką bendro turi vieno periodo elementai?
A: Periodo elementai turi iš eilės einančius atominius numerius.
K: Ką bendro turi grupės elementai?
A: Grupės elementai turi panašiai išsidėsčiusius elektronus pagal valentingumo elektronų skaičių, todėl jų cheminės savybės yra panašios.
K: Kas išrado periodinę lentelę?
A: Periodinę lentelę išrado rusų chemikas Dmitrijus Ivanovičius Mendelejevas (1834-1907 m.).
K: Kokios yra trys pagrindinės periodinės lentelės grupės?
A: Trys pagrindinės periodinės lentelės grupės yra metalai, metaloidai ir nemetalai.
K: Kaip galima pastebėti dėsningumus ir ryšius tarp elementų naudojant periodinę lentelę?
A: Dėsningumus ir ryšius tarp elementų galima pastebėti pažvelgus į jų vietą Periodinėje lentelėje, pavyzdžiui, elementai, esantys kairėje apačioje, paprastai yra metalingesni už esančius viršuje dešinėje.
Ieškoti