Elektronas: apibrėžimas, savybės ir pritaikymai
Elektronas: apibrėžimas, savybės ir pritaikymai — sužinokite jo istoriją, krūvį, judėjimą ir panaudojimą elektronikoje bei moksle aiškiai ir suprantamai.
Elektronas yra labai maža materijos ir energijos dalelė. Jo simbolis yra e− . Jį 1897 m. atrado J. J. Thomsonas.
Elektronas yra subatominė dalelė. Manoma, kad jis yra elementarioji dalelė, nes negali būti suskaidytas į mažesnes daleles. Jis turi neigiamą krūvį ir gali judėti beveik šviesos greičiu.
Elektronai dalyvauja gravitacinėje, elektromagnetinėje ir silpnojoje sąveikose. Elektra, kuria maitinami televizoriai, varikliai, mobilieji telefonai ir daugelis kitų daiktų, iš tikrųjų yra daugybė elektronų, judančių laidais ar kitais laidininkais.
Savybės ir pagrindiniai parametrai
Keletas svarbiausių elektronų fizikinių savybių:
- Krūvis: −1,602176634×10−19 kulonų (C).
- Masė: apie 9,10938356×10−31 kg (poilsio masė). Tai atitinka energiją ~0,511 MeV pagal E=mc2.
- Spinas: 1/2 — elektronas yra fermionas ir paklūsta Pauli išskyrimo principui.
- Leptonų skaičius: elektronas yra leptonas; jo antipartikulė yra pozitronas (e+).
- Struktūra: iki šiol elektronas laikomas taškine, neturinčia žinomos vidinės sandaros (elementarioji dalelė).
Elektrono vaidmuo atomuose ir cheminėse reakcijose
Elektronai užima atomo apvalkalus ir orbitinius būsenas, todėl lemia chemines savybes ir ryšius tarp atomų. Elektronų pasidalijimas, perėjimai tarp energetinių lygių ir elektronų praradimas arba priėmimas formuoja jonus bei chemines jungtis. Kvantinė mechanika aprašo elektronų būsenas atomo orbitalėmis — tai tikimybės pasiskirstymai, kur galima rasti elektroną.
Kvantinės savybės ir banginė prigimtis
Elektronai turi dvilypę prigimtį: jie elgiasi tiek kaip dalelės, tiek kaip bangos. Tai matyti iš de Broglie banginės ilgio formulės (λ = h/p) ir elektronų difrakcijos eksperimentų. Elektronų elgesį atomuose ir medžiagose aprašo kvantinė teorija: Schrödingerio arba Diraco lygtys ir Fermi–Dirac statistika daugeliui elektronų sistemų.
Elektronai medžiagoje ir elektros srovė
Metaluose laisvieji elektronai sudaro „Fermi jūrą“ ir yra pagrindiniai elektros laidininkai. Elektros srovė – tai elektronų masės nukreipta judėjimo forma laidininkuose; nors atskirų elektronų drifto greitis yra palyginti mažas, elektrinis signalas sklinda beveik šviesos greičiu per elektros lauką. Puslaidininkiuose elektronų skaičių ir judrumą lemia dopinimas bei energetinės juostos (valentinė ir laidumo juosta), o tai yra pagrindas tranzistoriams, diodams ir kitai mikroelektronikai.
Praktiniai pritaikymai
- Elektronika: tranzistoriai, integrinės grandinės, mikroprocesoriai.
- Optoelektronika: LED, lazeriai, fotodetektoriai (elektronų perėjimai su spinduliavimo arba absorbcijos emisija).
- Vakuuminės lempas ir CRT: ankstyvosios vaizdo ir radijo technologijos naudojo elektronų sroves vakuume.
- Elektronų mikroskopija: transmisinė ir skenuojanti elektronų mikroskopija (TEM, SEM) leidžia vaizduoti struktūras žymiai mažesnes nei optinis ribojimas.
- Skeneriai ir lithografija: elektronų spinduliai naudojami puslaidininkių gamyboje ir medžiagų apdorojime.
- Medicininės taikomosios sritys: elektronų spinduliai naudojami radioterapijoje kai kurių vėžio gydymui; aukštos energijos elektronai taip pat gamina rentgeno spindulius (bremsstrahlung).
- Moksliniai prietaisai: dalelių greitintuvai, detektoriai ir spektrometrai tiriant materijos struktūrą.
Istorija ir matavimai
Elektrono egzistavimą ir savybes pirmą kartą identifikavo J. J. Thomsonas 1897 m. per katodinių spindulių tyrimus, o vėliau R. A. Millikanas atliko žinomą aliejaus lašelio eksperimentą, kuriuo 1910–1913 m. tiksliai nustatė elektrono krūvį. Šie eksperimentai padėjo suformuoti moderniosios atomistikos ir teorinės fizikos pagrindus.
Sąveikos su kitomis jėgomis ir sauga
Nors elektronai dalyvauja gravitacinėje, elektromagnetinėje ir silpnojoje sąveikose, jų poveikis per gravitaciją yra beveik nepastebimas dėl mažos masės; stipriausia įtaka yra elektromagnetinė. Didelės energijos elektronai gali jonizuoti atomus ir pažeisti audinius, todėl dirbant su intensyviais elektronų šaltiniais reikalinga apsauga ir atitinkamos saugos priemonės.
Santrauka
Elektronas yra fundamentali dalelė, esminė tiek mikroskopinėms atomų savybėms, tiek kasdieniams technologiniams sprendimams. Jo charakteristika — neigiamas krūvis, labai maža masė, pusiau visuotinis vaidmuo elektroninėse sąveikose ir kvantinė prigimtis — daro jį kertiniu fizikinių ir inžinerinių procesų elementu.
Aprašymas
Elektronai turi mažiausią elektros krūvį. Šis elektros krūvis yra lygus protono krūviui, bet turi priešingą ženklą. Dėl šios priežasties elektronus traukia atomų branduolių protonai ir paprastai jie sudaro atomus. Elektrono masė yra maždaug 1/1836 protono masės.
Vienas iš būdų galvoti apie elektronų išsidėstymą atome - įsivaizduoti, kad jie skrieja nustatytais atstumais nuo branduolio. Tokiu būdu atomo elektronai egzistuoja keliuose elektronų apvalkaluose, supančiuose centrinį branduolį. Kiekvienam elektronų apvalkalui suteikiamas skaičius 1, 2, 3 ir t. t., pradedant nuo arčiausiai branduolio esančio (vidinio apvalkalo). Kiekviename apvalkale gali būti ne daugiau kaip tam tikras maksimalus elektronų skaičius. Elektronų pasiskirstymas įvairiuose apvalkaluose vadinamas elektroniniu išsidėstymu (arba elektronine forma ar pavidalu). Elektroninis išsidėstymas gali būti pavaizduotas numeracija arba elektronų diagrama. (Kitas būdas mąstyti apie elektronų išsidėstymą - pasitelkus kvantinę mechaniką apskaičiuoti jų atomines orbitales).
Elektronas yra viena iš subatominių dalelių, vadinamų leptonais. Elektronas turi neigiamą elektros krūvį. Elektronas turi dar vieną savybę, vadinamą sukiniu. Jo sukinio vertė yra 1/2, todėl jis yra fermionas.
Dauguma elektronų yra atomuose, tačiau kiti elektronai materijoje juda savarankiškai arba kartu kaip katodiniai spinduliai vakuume. Kai kuriuose superlaidininkuose elektronai juda poromis. Kai elektronai teka, šis srautas vadinamas elektra arba elektros srove.
Objektą galima apibūdinti kaip neigiamai įkrautą, jei jame yra daugiau elektronų nei protonų, arba kaip teigiamai įkrautą, jei jame yra daugiau protonų nei elektronų. Elektronai gali judėti iš vieno objekto į kitą, kai prie jų prisiliečiama. Jie gali būti pritraukiami prie kito objekto, turinčio priešingą krūvį, arba atstumiami, kai abu objektai turi vienodą krūvį. Kai objektas "įžeminamas", įkrauto objekto elektronai pereina į žemę, todėl objektas tampa neutralus. Taip daro žaibolaidžiai (žaibolaidžiai).
Cheminės reakcijos
Cheminių reakcijų pagrindas - aplink atomą išsidėstę elektronai. Užpildyti išoriniai apvalkalai, kuriuose yra daugiausia elektronų, yra mažiau reaktyvūs. Išoriniai apvalkalai su mažiau nei maksimalus elektronų skaičius yra reaktyvūs. Elektronų skaičius atomuose yra cheminės periodinės lentelės pagrindas.
Matavimas
Elektros krūvį galima tiesiogiai išmatuoti prietaisu, vadinamu elektrometru. Elektros srovę galima tiesiogiai išmatuoti galvanometru. Galvanometro rodmenys skiriasi nuo elektrometro rodmenų. Šiandien laboratoriniais prietaisais galima sulaikyti ir stebėti atskirus elektronus.
Elektronų "matymas
Laboratorinėmis sąlygomis atskirų elektronų sąveiką galima stebėti naudojant dalelių detektorius, kurie leidžia išmatuoti konkrečias savybes, pavyzdžiui, energiją, sukinį ir krūvį. Vienu atveju Penningo gaudyklėje vienas elektronas buvo laikomas 10 mėnesių. Elektrono magnetinis momentas buvo išmatuotas vienuolikos skaitmenų tikslumu, o tai 1980 m. buvo didesnis tikslumas nei bet kurios kitos fizikinės konstantos.
Pirmuosius elektronų energijos pasiskirstymo vaizdo vaizdus 2008 m. vasario mėn. užfiksavo Lundo universiteto (Švedija) komanda. Mokslininkai naudojo itin trumpus šviesos blyksnius, vadinamus atosekundiniais impulsais, kurie pirmą kartą leido stebėti elektrono judėjimą. Taip pat galima vizualizuoti elektronų pasiskirstymą kietosiose medžiagose.
Antidalelės
Elektrono antidalelė vadinama pozitronu. Jis yra identiškas elektronui, tačiau turi priešingo ženklo elektros ir kitus krūvius. Kai elektronas susiduria su pozitronu, jie gali išsisklaidyti vienas nuo kito arba visiškai anihiliuoti ir susidaryti gama spindulių fotonų pora (ar daugiau).
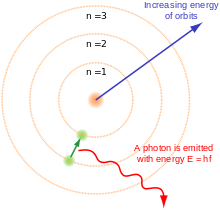
Nilso Boro atomo modelis. Trys elektronų apvalkalai aplink branduolį, elektronas pereina iš antrojo į pirmąjį lygmenį ir išlaisvina fotoną.
Atradimo istorija
Elektronų poveikis buvo žinomas gerokai anksčiau, nei jį pavyko paaiškinti. Senovės graikai žinojo, kad gintaro trynimas į kailį pritraukia mažus objektus. Dabar žinome, kad trynimas atima elektronus, o tai suteikia gintarui elektros krūvį. Daugybė fizikų dirbo su elektronais. J. J. Thomsonas 1897 m. įrodė, kad jis egzistuoja, tačiau kitas žmogus jam suteikė elektronų pavadinimą.
Elektronų debesies modelis
Pagal šį modelį elektronai laikomi neapibrėžtos padėties išsklaidytame debesyje aplink atomo branduolį.
Neapibrėžtumo principas reiškia, kad žmogus negali žinoti elektrono padėties ir energijos lygio tuo pačiu metu. Šios potencialios būsenos sudaro debesį aplink atomą. Vieno atomo elektronų potencinės būsenos sudaro vieną vientisą debesį.
Susiję puslapiai
- Pozitronas
- Protonas
- Neutronų
Klausimai ir atsakymai
K: Kas yra elektronas?
A: Elektronas yra labai maža materijos dalelė, subatominė dalelė. Jis negali būti suskaidytas į mažesnes dalis ir turi neigiamą elektros krūvį.
K: Kas atrado elektroną?
A: Elektroną 1897 m. atrado J. J. Thomsonas.
K: Kokią masę turi elektronas?
A: Elektronai turi labai mažą masę arba svorį, todėl jiems greitai judėti reikia labai mažai energijos.
K: Kokio tipo sąveikose dalyvauja elektronai?
A: Elektronai dalyvauja gravitacinėje, elektromagnetinėje ir silpnojoje sąveikose. Elektromagnetinė jėga yra stipriausia įprastose situacijose.
K: Kaip elektronai sąveikauja tarpusavyje?
Atsakymas: Elektronai atstumia vienas kitą, nes turi vienodą elektros krūvį, tačiau juos traukia protonai, nes jie turi priešingus elektros krūvius.
K: Kas maitina televizorius, variklius, mobiliuosius telefonus ir daugelį kitų daiktų?
A: Šiuos prietaisus maitinanti elektra iš tikrųjų yra daugybė elektronų, judančių laidais ar kitais laidininkais.
Ieškoti