Cheminė reakcija – kas tai? Apibrėžimas, pavyzdžiai ir tipai
Cheminė reakcija: aiškus apibrėžimas, realūs pavyzdžiai ir pagrindiniai tipai — sužinokite, kaip vyksta reakcijos, energijos pokyčiai ir kas lemia jų greitį.
Cheminė reakcija vyksta tada, kai viena ar daugiau cheminių medžiagų virsta viena ar daugiau kitų cheminių medžiagų. Pavyzdžiai:
- geležis ir deguonis jungiasi į rūdis.
- actas ir geriamoji soda susijungia į natrio acetatą, anglies dioksidą ir vandenį.
- degantys arba sprogstantys daiktai.
- daugybė reakcijų, vykstančių gyvų organizmų viduje.
- elektrocheminės reakcijos iškraunant arba įkraunant akumuliatorius.
Vienos reakcijos yra greitos, kitos - lėtos. Kai kurios vyksta skirtingu greičiu, priklausomai nuo temperatūros ar kitų dalykų. Pavyzdžiui, šalta mediena nereaguoja su oru, tačiau, jei ją pakankamai įkaitinsime, ji pradės degti. Kai kurių reakcijų metu išsiskiria energija. Tai egzoterminės reakcijos. Kitų reakcijų metu energija yra gaunama. Tai endoterminėsreakcijos.
Branduolinės reakcijos nėra cheminės reakcijos. Cheminėse reakcijose dalyvauja tik atomų elektronai; branduolinėse reakcijose dalyvauja atomo branduolio protonai ir neutronai.
Ką reiškia cheminė reakcija iš esmės?
Cheminėje reakcijoje pradinės medžiagos (reaktantai) perima elektronus, sudaro arba laužo cheminius ryšius ir taip susidaro naujos medžiagos (produktai). Reakcijos metu galioja atomų ir masės išsaugojimo dėsnis: atomų skaičius prieš ir po reakcijos nesikeičia, todėl chemines reakcijas žymime subalansuotomis cheminėmis lygtimis.
Pavyzdžiai lygtimis:
- Acto ir geriamųjų sodų reakcija: CH3COOH + NaHCO3 → CH3COONa + CO2 ↑ + H2O
- Geležies rūdijimas (supaprastinta): 4 Fe + 3 O2 → 2 Fe2O3
Cheminės reakcijos pagrindiniai požymiai
- Ryšių peržaidimas: susidaro nauji cheminiai ryšiai ir yra suardomi seni.
- Energijos pokyčiai: išsiskyrimas (egzoterminės) arba absorbcija (endoterminės), dažnai matomi kaip temperatūros pokytis, šviesa ar garsas.
- Spalvos, kvapo ar dujų išsiskyrimas: kartais pasikeičia reagentų spalva arba susidaro naujas kvapas; pavyzdžiui, CO2 burbuliukai acto ir sodos mišinyje.
- Nuosėdos susidarymas: kai produktas yra netirpūs junginiai (precipitacija).
Cheminių reakcijų tipai (trumpai)
- Sintezė (kombinacija): du arba daugiau reagentų susijungia į vieną produktą (A + B → AB).
- Skaidymas (dekompozicija): vienas junginys skyla į paprastesnes dalis (AB → A + B).
- Vienvietis pakeitimas (metatezė): vienas atomų ar jonų pakeičia kitą (A + BC → AC + B).
- Dviejų vietų pakeitimas (dviguba metatezė): jonai keičiasi vietomis (AB + CD → AD + CB), dažnai matoma druskų tirpimo ir nuosėdų formavimo procesuose.
- Degimas (kombustija): reakcijos su deguonimi, dažnai greitos ir egzoterminės; pavyzdys — organinių medžiagų degimas.
- Redoks reakcijos: vyksta elektronų pernaša (oksidacija ir redukcija).
- Acidų ir bazių reakcijos: protonų pernaša, neutralizacija (H+ + OH− → H2O).
- Polimerizacija: mažos molekulės susijungia į dideles polimerines grandines.
Veiksniai, lemiantys reakcijos greitį
- Temperatūra: didesnė temperatūra paprastai didina dalelių kinetinę energiją ir reakcijų greitį.
- Koncentracija: didesnė reagento koncentracija didina susidūrimų tikimybę.
- Paviršiaus plotas: kietų dalelių smulkinimas (didesnis plotas) pagreitina reakcijas su tirpikliu ar oru.
- Slėgis: svarbu dujų reakcijoms — didesnis slėgis gali padidinti reakcijų greitį.
- Katalizatoriai: medžiagos, kurios mažina aktyvacinę energiją ir pagreitina reakciją, bet nešvaisto paties katalizatoriaus.
- Šviesa: fotocheminės reakcijos vyksta apšvietus (pvz., fotosintezė, fotochemija).
Reversiškumas ir cheminė pusiausvyra
Daugelis reakcijų yra grįžtamos — produktai gali reaguoti atgal į reagentus. Kai į priekį ir atgal vykstančių procesų greičiai susilygina, susidaro dinaminė cheminė pusiausvyra. Pusiausvyros padėtį nulemia koncentracijos, temperatūros ir slėgio pokyčiai (Le Châtelier principas).
Cheminės ir fizinės reakcijos skirtumai
Cheminė reakcija reiškia medžiagų cheminį perskirstymą ir naujų medžiagų susidarymą. Fiziniai pokyčiai (pvz., lydymas, garavimas) nekeičia medžiagų cheminės sudėties — tik būseną ar formą.
Praktinė reikšmė ir sauga
Cheminės reakcijos yra kasdienio gyvenimo dalis: gaminame maistą, kuras, medikamentus, sintetinius polimerus, valiklius, ir kt. Daugelis pramoninių procesų priklauso nuo efektyvių ir saugių cheminių reakcijų. Tačiau kai kurios reakcijos gali būti pavojingos (sprogimai, toksiški dujų išsiskyrimai, stiprus šilumos išsiskyrimas), todėl svarbu laikytis saugos priemonių: naudoti tinkamą apsaugos įrangą, vėdinimą ir saugias darbo procedūras.
Pastaba apie branduolines reakcijas
Kaip nurodyta aukščiau, branduolinės reakcijos nėra cheminės reakcijos — jose keičiasi atomo branduolio sudėtis (protonai, neutronai), o cheminėse reakcijose pokyčiai vyksta elektronų lygmenyje (elektronai).
Jeigu norite, galiu pateikti iliustracijas ar paprastus uždavinius apie reakcijų balansavimą, katalizatorių veikimą ar paaiškinti konkrečių pavyzdžių mechanizmus detaliau.

Rūdijanti geležis

Ugnis yra redokso pavyzdys
Keturi pagrindiniai tipai
Sintezė
Sintezės reakcijos metu dvi ar daugiau paprastų medžiagų susijungia, kad susidarytų sudėtingesnė medžiaga.
A + B ⟶ A B {\displaystyle A+B\ilgoji dešinioji rodyklė AB}
"Du ar daugiau reagentų duoda vieną produktą" - tai dar vienas būdas nustatyti sintezės reakciją. Vienas iš sintezės reakcijos pavyzdžių yra geležies ir sieros junginys, kurio metu susidaro geležies(II) sulfidas:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Kitas pavyzdys - paprastos vandenilio dujos, sujungtos su paprastomis deguonies dujomis, sudaro sudėtingesnę medžiagą, pavyzdžiui, vandenį.
Skaidymas
Skaidymo reakcija - kai sudėtingesnė medžiaga skyla į paprastesnes dalis. Taigi ji yra priešinga sintezės reakcijai ir ją galima užrašyti taip:
A B ⟶ A + B {\displaystyle AB\ilgoji dešinioji rodyklė A+B}
Vienas iš skilimo reakcijos pavyzdžių - vandens elektrolizė, kurios metu susidaro deguonies ir vandenilio dujos:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}}
Vienkartinis pakeitimas
Vienkartinės pakeitimo reakcijos metu vienas nesujungtas elementas pakeičia kitą elementą junginyje, kitaip tariant, vienas elementas pakeičia kitą elementą junginyje:
A + B C ⟶ A C + B {\displaystyle A+BC\ilgoji ištisinė rodyklė AC+B}
Vienas iš vieno išstūmimo reakcijos pavyzdžių - kai magnis pakeičia vandenilį vandenyje ir susidaro magnio hidroksidas ir vandenilio dujos:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}
Dvigubas pakeitimas
Dvigubo pakeitimo reakcijos metu dviejų junginių anijonai ir katijonai pasikeičia vietomis ir susidaro du visiškai skirtingi junginiai. Šios reakcijos yra bendros formos:
A B + C D ⟶ A D + C B {\displaystyle AB+CD\ilgoji dešinioji rodyklė AD+CB}
Pavyzdžiui, reaguojant bario chloridui (BaCl2 ) ir magnio sulfatui (MgSO4 ), SO42− anijonas susikeičia vietomis su 2Cl−anijonu ir susidaro BaSO 4ir MgCl 2junginiai.
Kitas dvigubo išstūmimo reakcijos pavyzdys - švino(II) nitrato reakcija su kalio jodidu, kai susidaro švino(II) jodidas ir kalio nitratas:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}}
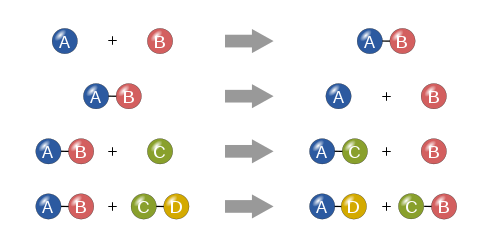
Keturios pagrindinės cheminių reakcijų rūšys: sintezė, skilimas, vienkartinis pakeitimas ir dvigubas pakeitimas.
Lygtys
Cheminė reakcija vaizduojama lygtimi:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\ilgoji rodyklė C+D} }
Šiuo atveju cheminės reakcijos metu A ir B reaguoja į C ir D.
Tai degimo reakcijos pavyzdys.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Susiję puslapiai
- Organinė reakcija
- Redoksas
Klausimai ir atsakymai
K: Kas yra cheminė reakcija?
Atsakymas: Cheminė reakcija vyksta, kai viena ar daugiau cheminių medžiagų virsta viena ar daugiau kitų cheminių medžiagų.
K: Ar galite pateikti cheminių reakcijų pavyzdžių?
Atsakymas: Taip, keletas cheminių reakcijų pavyzdžių: geležis ir deguonis susijungia į rūdis, actas ir soda susijungia į natrio acetatą, anglies dioksidas ir vanduo, degantys ar sprogstantys daiktai ir daugelis reakcijų, vykstančių gyvų organizmų viduje, pavyzdžiui, fotosintezė.
K: Ar visos cheminės reakcijos yra greitos?
Atsakymas: Ne, kai kurios reakcijos yra greitos, o kitos lėtos. Kai kurios vyksta skirtingu greičiu, priklausomai nuo temperatūros ar kitų dalykų.
K: Kas yra egzoterminė reakcija?
A: Egzoterminė reakcija - tai reakcija, kurios metu išsiskiria energija.
K: Kas yra endoterminė reakcija?
A: Endoterminė reakcija - tai reakcija, kurios metu gaunama energija.
K: Ar branduolinės reakcijos laikomos cheminėmis reakcijomis?
Atsakymas: Ne, branduolinės reakcijos nėra cheminės reakcijos. Cheminėse reakcijose dalyvauja tik atomų elektronai; branduolinėse reakcijose dalyvauja atomo branduolio protonai ir neutronai.
K: Ar temperatūra gali turėti įtakos cheminės reakcijos greičiui?
Atsakymas: Taip, priklausomai nuo temperatūros ar kitų dalykų, kai kurios reakcijos gali vykti skirtingu greičiu. Pavyzdžiui, šalta mediena nereaguoja su oru, tačiau, jei ją pakankamai įkaitinsime, ji pradės degti.
Ieškoti









