Baterija (akumuliatorius): apibrėžimas, veikimo principas ir tipai
Sužinokite, kas yra baterija (akumuliatorius), kaip ji veikia, kokie jos tipai, skirtumai tarp pirminių ir antrinių bei praktinis panaudojimas kasdienėje technikoje.
Akumuliatoriuje cheminė energija cheminės reakcijos metu paverčiama elektros energija. Paprastai cheminės medžiagos laikomos akumuliatoriaus viduje. Jis naudojamas grandinėje kitiems komponentams maitinti. Akumuliatoriuje gaminama nuolatinės srovės (DC) elektra (elektra, kuri teka viena kryptimi ir nesikeičia pirmyn ir atgal).
Naudoti elektros energiją iš pastato elektros lizdo yra pigiau ir efektyviau, tačiau akumuliatorius gali tiekti elektrą tose vietovėse, kuriose nėra elektros energijos paskirstymo. Ji taip pat naudinga judantiems daiktams, pavyzdžiui, elektra varomoms transporto priemonėms ir mobiliesiems telefonams.
Baterijos gali būti pirminės arba antrinės. Pirminė baterija išmetama, kai nebegali tiekti elektros energijos. Antrinę bateriją galima įkrauti ir naudoti pakartotinai.
Veikimo principas
Akumuliatorius (baterija) sudarytas iš dviejų elektrodų — anodo ir katodo — bei tarp jų esančio elektrolito. Veikiant išoriniam grandinės apkrovai, vyksta elektros cheminė (redoks) reakcija: viename elektrode medžiaga oksiduojasi (atiduoda elektronus), kitame — redukuojasi (priima elektronus). Elektronai šį kelią nukeliauja per išorinę grandinę (tiekdami elektros srovę), o jonai juda per elektrolitą, kad užtikrintų elektrinį balansą.
Įkrovimo metu (antrinėse baterijose) ši reakcija yra apgręžiama — išorinė elektros energija verčia medžiagas atgauti pradinę cheminę būseną. Kiekvienos akumuliatoriaus cheminės poros susijusi įtampa (EMF) lemia nominalų baterijos įtampą, o serijinis arba lygiagretus elementų sujungimas leidžia pasiekti reikiamą įtampą ir talpą.
Pagrindiniai parametrai
- Nominali įtampa: tipiška įtampa vienam elementui priklauso nuo medžiagų (pvz., 1,2 V NiMH, 1,5 V alkalinė, ~3,6–3,7 V Li-ion).
- Talpa: matuojama ampervalandėmis (Ah) arba miliampervalandėmis (mAh) — nurodo, kiek srovės baterija gali tiekti per tam tikrą laiką.
- Energijos tankis: matuojamas Wh/kg; svarbus mobilumo ir svorio atžvilgiu.
- Galia ir vidinis pasipriešinimas: lemia, kiek srovės baterija gali duoti trumpais impulsais be reikšmingo įtampos kritimo.
- Ciklinis tarnavimo laikas (Cycle life): kiek pakrovimo/ikrovimo ciklų baterija gali atlaikyti nepraradusi didelės dalies talpos.
- Savipaleidimas: baterijos vidinis savaiminis išsikrovimas per laiką.
Tipai ir jų savybės
Pagal galimybę įkrauti:
- Pirminės (vienkartinės): negali būti saugiai arba efektyviai įkraunamos. Pavyzdžiai: cinkas–anglis, alkalinės, tam tikros ličio pirminės baterijos. Jų privalumas — žema kaina ir ilgas laikymo laikas; trūkumas — atliekamos ir neišnaudojamos pabaigoje.
- Antrinės (įkraunamos): skirtos daugkartiniam naudojimui. Pavyzdžiai: svino rūgštinės (automobilių akumuliatoriai), NiMH, NiCd, Li-ion, LiFePO4. Privalumai — ekonomiškesnės ilgalaikėje perspektyvoje; trūkumai — reikalauja tinkamo įkrovimo ir priežiūros.
Praktiniai panaudojimo pavyzdžiai
- Mobilieji telefonai, nešiojami kompiuteriai, planšetės — dažniausiai Li-ion akumuliatoriai.
- Elektros transportas (elektromobiliai, elektriniai dviračiai) — didelės talpos Li-ion arba LiFePO4 pakabinamos baterijos.
- Automobilių starteriai — tradiciškai svino rūgštinės baterijos.
- Namų energijos saugojimas (saulės baterijų sistemos) — naudojamos akumuliatorių bankai (svino rūgštinės arba ličio pagrindo).
- Avarinis maitinimas (UPS), medicininė įranga, ryšio stotys — reikalauja stabilios ir patikimos energijos tiekimo.
Saugumas ir aplinkosauga
Akumuliatoriai gali kelti kelią saugumo ir aplinkosaugos rizikų:
- Li-ion baterijos gali patirti termininį bėgimą (thermal runaway) ir užsidegti, jei jos pažeistos, perkaista arba neteisingai įkraunamos. Todėl svarbu naudoti atitinkamus įkroviklius ir apsaugines grandines.
- Senos ar pažeistos baterijos gali nutekėti toksiškų medžiagų (pvz., švino, kadmio) — tai kenkia aplinkai ir sveikatai.
- Atliekamos baterijos reikia tvarkyti pagal vietos teisės aktus — dažnai yra specialios surinkimo ir perdirbimo schemos.
Įkrovimas ir priežiūra
Keletas praktinių patarimų baterijų tarnavimo laikui pailginti:
- Naudokite originalius arba tinkamus, gamintojo rekomenduojamus įkroviklius (ypač svarbu Li-ion baterijoms).
- Venkite ekstremalių temperatūrų — itin didelė arba žema temperatūra mažina baterijos efektyvumą ir trumpina gyvenimą.
- Antrinėms baterijoms nereikėtų nuolat leisti visiškai išsikrauti (giliai iškrauti), nebent tai rekomenduojama gamintojo (NiCd „atminties“ efektui mažinti). Daugumai Li-ion baterijų geriau palaikyti vidutinį įkrovos lygį (pvz., 20–80 % arba ~40–60 % ilgalaikiam saugojimui).
- Sekite ciklų skaičių ir talpos pokyčius — pastebimas greitas talpos mažėjimas gali reikšti, kad baterija artėja prie pabaigos.
Perdirbimas ir teisės aktai
Baterijos turėtų būti perdirbamos ar utilizuojamos pagal vietos taisykles. Daugelyje šalių yra specialios surinkimo stotys arba prekybos tinklai priima senas baterijas. Perdirbimas leidžia atgauti metalus (pvz., šviną, ličio druskas, varį) ir sumažinti žaliavų gavybos poveikį aplinkai.
Apibendrinant: baterija yra būtinas šiuolaikinių įrenginių komponentas — nuo mažų nuotolinių pultelių iki didelių energijos saugyklų. Renkantis baterijos tipą svarbu atsižvelgti į jos paskirtį, energetinius parametrus, saugumo reikalavimus ir poveikį aplinkai.

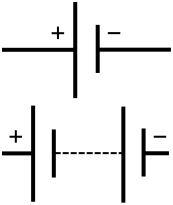
Akumuliatoriaus schematinis simbolis
Akumuliatoriaus cheminė sudėtis
Akumuliatorių gali sudaryti vienas arba daug elementų. Kiekvienas elementas turi anodą, katodą ir elektrolitą. Elektrolitas yra pagrindinė akumuliatoriaus medžiaga. Dažnai tai būna tam tikros rūšies rūgštis, kurią liesti gali būti pavojinga. Anodas reaguoja su elektrolitu ir išskiria elektronus (tai neigiamas arba - galas). Katodas reaguoja su elektrolitu ir priima elektronus (tai teigiamas arba + galas). Elektros srovė atsiranda, kai laidas sujungia anodą su katodu, ir elektronai juda iš vieno galo į kitą. (Tačiau akumuliatorių galima sugadinti vien laidu, jungiančiu abu galus, todėl tarp abiejų galų reikia ir apkrovos. Apkrova yra kažkas, kas sulėtina elektronų judėjimą ir paprastai atlieka kažką naudingo, pavyzdžiui, lemputė žibintuvėlyje arba elektronika skaičiuotuve).Elektrolitas gali būti skystas arba kietas. Priklausomai nuo elektrolito tipo, akumuliatorius vadinamas šlapio arba sauso elemento akumuliatoriumi.
Akumuliatoriuje vykstančios cheminės reakcijos yra egzoterminės reakcijos. Šio tipo reakcijų metu susidaro šiluma. Pavyzdžiui, jei ilgai paliksite įjungtą nešiojamąjį kompiuterį ir paliesite akumuliatorių, jis bus šiltas arba karštas.
Įkraunama baterija įkraunama keičiant baterijoje vykstančios cheminės reakcijos kryptį. Tačiau įkraunamą akumuliatorių galima įkrauti tik tam tikrą skaičių kartų (įkrovimo trukmė). Net įmontuotų akumuliatorių negalima įkrauti visam laikui. Be to, kiekvieną kartą įkraunant akumuliatorių, jo gebėjimas išlaikyti įkrovą šiek tiek sumažėja. Neįkraunamų akumuliatorių nereikėtų įkrauti, nes gali ištekėti įvairių kenksmingų medžiagų, pavyzdžiui, kalio hidroksido.
Elementus galima sujungti, kad susidarytų didesnis akumuliatorius. Vieno elemento teigiamo elemento teigiamąjį junginį sujungus su kito neigiamuoju, jie vadinami nuosekliuoju jungimu. Kiekvieno akumuliatoriaus įtampa sudedama. Du nuosekliai sujungti šešių voltų akumuliatoriai sukurs 12 voltų įtampą.
Vieno elemento teigiamąjį junginį sujungus su kito teigiamuoju, o neigiamąjį - su neigiamuoju, vadinama lygiagrečiuoju jungimu. Įtampa išlieka ta pati, bet srovė sumuojama. Įtampa yra slėgis, stumiantis elektronus per laidus, ji matuojama voltais. Srovė - tai kiek elektronų gali tekėti vienu metu, ji matuojama amperais. Srovės ir įtampos derinys yra akumuliatoriaus galia (vatai = voltai x amperai).
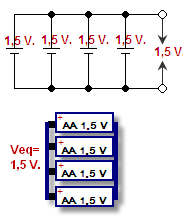
Lygiagrečiai sujungti akumuliatoriai - parodyta schemoje ir brėžinyje
Akumuliatorių dydžiai
Akumuliatoriai būna įvairių formų, dydžių ir įtampų.AA, AAA, C ir D elementai, įskaitant šarmines baterijas, yra standartinių dydžių ir formų, o jų įtampa yra apie 1,5 V. Elemento įtampa priklauso nuo naudojamų cheminių medžiagų. Elektros krūvis, kurį jis gali suteikti, priklauso nuo to, kokio dydžio yra elementas, taip pat nuo to, kokios cheminės medžiagos. Akumuliatoriaus tiekiamas krūvis paprastai matuojamas ampervalandėmis. Kadangi įtampa išlieka ta pati, didesnis krūvis reiškia, kad didesnis elementas gali tiekti daugiau amperų arba veikti ilgiau.
Istorija
Pirmasis akumuliatorius buvo išrastas 1800 Alessandro Volta. Šiandien jo baterija vadinama Volto baterija.Mažuose šiuolaikiniuose akumuliatoriuose skystis imobilizuojamas į tam tikrą pastą ir viskas dedama į sandarų korpusą. Dėl šio korpuso niekas negali išsilieti iš akumuliatoriaus. Didesniuose akumuliatoriuose, pavyzdžiui, automobilių akumuliatoriuose, vis dar yra skysčio ir jie nėra sandarūs. Antrojo pasaulinio karo metais buvo išrastas toks akumuliatorius, kuriame kaip elektrolitas naudojamos išlydytos druskos.
Akumuliatorių tipai
- Sausi elementai - elementai, kuriuose nėra skysčio (arba yra imobilizuoto skysčio, pvz., pastos ar gelio) kaip elektrolito.
- Pirminės ląstelės, ląstelės, kurių negalima įkrauti
- Šarminė baterija, "šarminė", neįkraunama
- Gyvsidabrio baterija, neįkraunama
- "Leclanche" akumuliatorius, "super heavy duty", neįkraunamas
- Ličio baterija, neįkraunama, "monetų elementas"
- Sidabro oksido baterija, neįkraunama, laikrodžio baterija
- Volto krūva, Allesandro Volto pirmasis akumuliatorius
- Antrinės ląstelės, ląstelės, kurias galima įkrauti
- Sandarus švino rūgšties akumuliatorius
- Įkraunama ličio jonų baterija, naudojama mobiliuosiuose telefonuose ir nešiojamuosiuose kompiuteriuose
- Nikelio-kadmio akumuliatorius, "NiCd", įkraunamas
- Įkraunama nikelio-metalo hidrido baterija, "NiMH"
- Nikelio-cinko baterija
- Drėgnieji elementai - elementai, kuriuose elektrolitas yra skystis.
- Švino rūgštinis akumuliatorius, įkraunamas, automobilio akumuliatorius
- Nikelio-geležies baterija, įkraunama, Edisono baterija
- Kuro elementas, įkraunamas įpilant degalų

Automobilio akumuliatoriaus vaizdas iš viršaus
Akumuliatorių alternatyvos
Kuro elementai ir saulės baterijos nėra akumuliatoriai, nes juose energija nekaupiama.Kondensatorius nėra akumuliatorius, nes jame nėra kaupiama cheminės reakcijos energija. Kondensatoriuje galima kaupti elektros energiją ir ją sukurti daug greičiau nei akumuliatoriuje, tačiau paprastai per brangiai kainuoja jį pagaminti tokio dydžio, koks gali būti akumuliatorius. Mokslininkai ir chemijos inžinieriai stengiasi sukurti geresnius kondensatorius ir baterijas elektromobiliams.
Nedideli elektros generatoriai, valdomi rankomis ir kojomis, gali tiekti energiją nedideliems elektros prietaisams. Laikrodiniai radijo imtuvai, laikrodiniai žibintuvėliai ir panašūs prietaisai taip pat turi užvedamą spyruoklę mechaninei energijai kaupti.
Klausimai ir atsakymai
K: Kas yra baterija?
Atsakymas: Baterija yra prietaisas, kuris cheminę energiją cheminės reakcijos metu paverčia elektros energija.
K: Kaip baterija gamina elektros energiją?
A: Akumuliatorius gamina nuolatinės srovės elektros energiją, kuri teka viena kryptimi ir nesikeičia pirmyn ir atgal.
K: Kur baterijoje laikomos cheminės medžiagos?
A.: Paprastai cheminės medžiagos yra akumuliatoriaus viduje.
K: Kuo skiriasi pirminis ir antrinis akumuliatorius?
A: Pirminis akumuliatorius išmetamas, kai nebegali tiekti elektros energijos, o antrinis akumuliatorius gali būti įkrautas ir naudojamas pakartotinai.
K: Kodėl baterijos yra naudingos?
A.: Baterijos naudingos elektros energijai tiekti vietovėse, kuriose nėra elektros energijos paskirstymo, ir judantiems daiktams, pavyzdžiui, elektra varomoms transporto priemonėms ir mobiliesiems telefonams.
K: Ar naudoti elektros energiją iš pastato elektros lizdo yra pigiau ir efektyviau nei naudoti akumuliatorių?
Atsakymas: Taip, naudoti elektros energiją iš pastato elektros lizdo yra pigiau ir efektyviau nei naudoti akumuliatorių.
K.: Kokio tipo elektrą gamina akumuliatorius?
A.: Akumuliatorius gamina nuolatinės srovės elektrą.
Ieškoti