Atomo orbitalės: apibrėžimas, tipai ir elektronų išsidėstymas
Atomo orbitalės: aiškus apibrėžimas, orbitalių tipai ir elektronų išsidėstymas suprantamai, su pavyzdžiais ir paaiškinimais — sužinokite daugiau!
Atomo orbitalės - tai atomo branduolį supančios vietos, kuriose bet kuriuo metu greičiausiai yra elektronų. Tai matematinė funkcija, apibūdinanti vieno elektrono arba elektronų poros banginį elgesį atome.
Žodis "orbitinis" vartojamas todėl, kad buvo manoma, jog elektronai elgiasi panašiai kaip Saulės sistemoje, kur branduolys yra tarsi Saulė, o elektronai skrieja kaip planetos.
Elemento atominių orbitų skaičių lemia periodas, kuriam priklauso elementas. Elektronai juda tarp orbitalių priklausomai nuo to, kaip greitai jie juda ir kiek yra kitų elektronų.
Atomo teorijoje ir kvantinėje mechanikoje atomo orbitalė yra kvantinis skaičius. Kiekvieną tokią orbitalę gali užimti vienas arba du elektronai. Orbitalių išsidėstymo būdas susijęs su atomų elektronų konfigūracijomis. Jos buvo išvestos iš ankstyvųjų spektroskopistų pateiktų tam tikrų šarminių metalų spektroskopinių linijų apibūdinimų kaip aštrios, pagrindinės, išsklaidytos ir ketvirtinės.
Ką orbitalė reiškia praktiškai
Orbitalė nėra trajektorija — tai banginės funkcijos ψ(x,y,z) (dažnai žymimos tik jų modulio kvadratu |ψ|²), kurios duoda tikimybę rasti elektroną tam tikroje erdvės dalyje. Didžiausia |ψ|² reikšmė ten, kur elektronas dažniausiai „randamas“. Orbitalės forma ir energija priklauso nuo kvantinių skaičių.
Kvantinių skaičių reikšmė
- Principalus skaičius n (n = 1,2,3,...) nurodo sluoksnį arba energijos lygį.
- Azimutinis (orbitalinis) skaičius l (l = 0,..., n−1) apibrėžia orbitalės formą: l = 0 → s, l = 1 → p, l = 2 → d, l = 3 → f ir t. t. t.
- Magnetinis skaičius m_l (m_l = −l ... +l) nurodo orbitalės orientaciją erdvėje — orientacijų skaičius lygus 2l+1.
- Elektrono sukimosi kvantinis skaičius m_s (m_s = +1/2 arba −1/2) leidžia vienoje orbitalėje sėdėti dviems elektronams su priešingu sukimusi — taip įgyvendinama Paulio uždraudimo principas.
Orbitalių tipai ir formos
- s-orbitalės (l = 0) yra sferiškai simetriškos aplink branduolį.
- p-orbitalės (l = 1) turi „dumbbelio“ formą — trys orientacijos (px, py, pz).
- d-orbitalės (l = 2) daugiausia turi keturialapius (cloverleaf) arba specialią dz2 formą — penkios orientacijos.
- f-orbitalės (l = 3) yra sudėtingesnės, su daug skirtingų lapų ir mazgų; jų yra septynios orientacijos.
Kiekviena orbitalė gali turėti daugiasluoksnę struktūrą su radialiniais mazgais — radialinių mazgų skaičius = n − l − 1; kampiniai (angular) mazgai priklauso nuo l.
Elektronų talpa ir orbitalių skaičiavimas
- Kiekviena orbitalė talpina iki 2 elektronų.
- Viename sluoksnyje (šiltoje energijos lygyje) orbitalių skaičius yra n², o maksimalus elektronų skaičius sluoksnyje yra 2n².
- Specifiškai: s — 2 el., p — 6 el., d — 10 el., f — 14 el.
Orbitalių užpildymas — taisyklės
Orbitalės užpildomos pagal keletą taisyklių, kurios apibūdina elektronų konfigūracijas:
- Aufbau (statymo) principas: elektronai užpildo žemiausios energijos orbitales pirmiausia (energijų eiliškumas dažnai nustatomas pagal n + l taisyklę).
- Paulio uždraudimo principas: vienoje orbitalėje negali būti dviejų elektronų su tomis pačiomis visomis keturiomis kvantinėmis reikšmėmis.
- Gundo taisyklė: kai keli degenerate orbitalai (pvz., trys p) yra laisvi, elektronai užpildo juos taip, kad būtų kuo daugiau nelyginių (vienos krypties) sukimų — tai sumažina elektronų atstūmimą.
Yra išimčių energijų eiliškumui (pvz., Cr, Cu ir kt.), kai dėl elektronų sąveikų ir atomo energetikos kai kuriuos elektronus prioritetu perkelia iš vienos srities į kitą.
Orbitalių vizualizacija ir mazgai
Orbitalės vaizduojamos kontūrų paviršiais, kuriuose |ψ|² turi tam tikrą reikšmę. Mazgai — tai taškai arba paviršiai, kur |ψ|² = 0. Radialiniai mazgai susiję su n ir l, o kampiniai mazgai su l ir m_l. Šios formos padeda paaiškinti, kodėl orbitalės skirtingai sąveikauja tarpusavyje ir su kitais atomais.
Orbitalių reikšmė cheminėse jungtyse
Orbitalės apibrėžia, kaip atomai jungiasi į molekules:
- Orbitalių persidengimas lemia cheminių jungčių stiprumą ir kryptį.
- Hybridizacija (pvz., sp, sp2, sp3) — tai atominių orbitalių linijinė kombinacija, sudaranti naujas orbitales, paaiškinančias geometriją organinėse molekulėse.
- Molekulinės orbitalės — atominių orbitalių kombinacijos, kurios gali būti ryšio (bonding) arba priešryšio (antibonding), ir jos nusako elektronų pasiskirstymą molekulėje.
Istorinis kontekstas
Orbitalės sąvoka vystėsi atliekant spektroskopinius tyrimus ir kuriant kvantinės mechanikos teoriją. Būtent spektroskopistų stebėtos linijos (pvz., šarminių metalų spektroskopinių linijų) padėjo susieti tam tikras energijos reikšmes su elektronų perėjimais. Tradicinės spektroskopijos žymės S, P, D, F kilo iš angl. žodžių sharp, principal, diffuse, fundamental ir suteikė pavadinimus orbitalių tipams s, p, d, f.
Santrauka
Atomo orbitalė — tai kvantinė funkcija, leidžianti prognozuoti, kur erdvėje dažniausiai bus elektronas. Orbitalės turi aiškias formas, energijas ir užpildymo taisykles, kurios kartu nusako atomų elgesį, jų chemines savybes ir molekulių struktūras. Supratimas apie orbitales — pagrindas cheminėms jungtims, spektroskopijai ir daugeliui šiuolaikinės fizikos bei chemijos sričių.
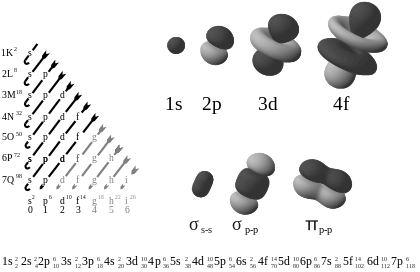
Kairėje diagramoje orbitalės pavaizduotos didėjančios energijos tvarka. Dešinėje pateikti orbitalių formų pavyzdžiai.
Susiję puslapiai
- Elektronų debesis
- Molekulinė orbitalė
Klausimai ir atsakymai
K: Kas yra atominės orbitalės?
A: Atominės orbitalės - tai sritys aplink atomo branduolį, kuriose greičiausiai yra elektronų.
K: Kokia matematinė funkcija apibūdina elektronų elgseną atome?
A: Matematinė funkcija, apibūdinanti elektronų elgseną atome, yra banginė funkcija.
K: Kodėl vartojamas žodis "orbitalė"?
A: Žodis "orbitalė" vartojamas apibūdinti sritims aplink branduolį, kuriose greičiausiai yra elektronų, nes kadaise buvo manoma, kad elektronai elgiasi kaip planetos, skriejančios aplink saulę.
K: Kaip nustatomas elemento atominių orbitų skaičius?
A: Atomų orbitalių skaičius elemente nustatomas pagal elemento periodą.
K: Kodėl elektronai juda tarp orbitalių?
A: Elektronai juda tarp orbitalių priklausomai nuo jų greičio ir kitų esančių elektronų skaičiaus.
K: Kas yra atominė orbitalė atomo teorijoje ir kvantinėje mechanikoje?
A: Atomo orbitalė yra kvantinis skaičius atomo teorijoje ir kvantinėje mechanikoje.
K: Kiek elektronų gali užimti kiekviena atominė orbitalė?
A: Kiekviena atomo orbitalė gali būti užimta vieno arba dviejų elektronų.
Ieškoti