Atomo teorija: istorija, atomų sandara ir šiuolaikiniai atradimai
Atomo teorija: nuo Demokrito iki šiuolaikinių atradimų — atomų sandara, protonai, neutronai, elektronai ir kvarkai. Sužinok istoriją ir naujausias naujoves.
Chemijoje ir fizikoje atomo teorija paaiškina, kaip laikui bėgant keitėsi mūsų supratimas apie atomą. Kadaise buvo manoma, kad atomai yra mažiausios medžiagos dalelės. Tačiau dabar žinoma, kad atomai sudaryti iš protonų, neutronų ir elektronų. Šios subatominės dalelės sudarytos iš kvarkų. Pirmąją idėją apie atomą pateikė graikų filosofas Demokritas. Daug šiuolaikinės teorijos idėjų kilo iš britų chemiko ir fiziko Džono Daltono.
Teorija taikoma kietiems kūnams, skysčiams ir dujoms, tačiau ji netaikoma plazmai ar neutroninėms žvaigždėms.
Istorija trumpai
Atomo samprata vystėsi etapais:
- Demokritas (V a. pr. Kr.) pasiūlė, kad materija susideda iš nedalomo „atomos“ — filosofinė idėja be eksperimentinio pagrindo.
- Džonas Daltonas (pradžia XIX a.) atgaivino atomų idėją, pateikė cheminio sudėties paaiškinimus ir masių santykius.
- J. J. Thomson (1897) atrado elektroną ir pasiūlė „raisinės pudingo“ modelį.
- Ernest Rutherford (1911) atliko spindulių sklaidos bandymus, atrado susitelkusį atomų branduolį.
- Niels Bohr (1913) pasiūlė kvantizuotus elektronų energetinius lygius, kurie paaiškino tam tikras spektro linijas.
- 1920–1930 m. išsivystė kvantinė mechanika (Schrödingeris, Heisenbergas), pakeitusi klasikinius Bohr modelius atomų aprašyme.
- James Chadwick (1932) atrado neutroną, paaiškinusį branduolio masės pasiskirstymą.
- 1964 m. Murray Gell‑Mann ir George Zweig nepriklausomai pasiūlė kvarkų modelį, paaiškinantį protonų ir neutronų vidinę sandarą.
Atomo sandara ir pagrindinės sąvokos
Šiuolaikinis atomo vaizdas: didžioji atomo masės dalis yra labai mažame, teigiamai įkrautame branduolyje, kuriame yra protonų ir neutronų. Aplink branduolį išsidėstę elektronai sudaro elektroninį debesį ar orbitales, kurios nulemia chemines savybes.
- Atominis numeris (Z) — protonų skaičius branduolyje; nulemia cheminį elementą.
- Masės skaičius (A) — protonų ir neutronų suma; skiriasi izotopams.
- Izotopai — tos pačios cheminės medžiagos atominės rūšys, turinčios skirtingą neutronų skaičių.
- Jonizacija — elektronų netekimas arba priėmimas, todėl atsiranda teigiamas arba neigiamas jonas.
Subatominės dalelės ir kvarkai
Svarbu tiksliai paaiškinti subatominių dalelių prigimtį: protonai ir neutronai yra sudaryti iš kvarkų (protonas paprastai − du „up“ kvarkai ir vienas „down“ kvarkas, neutrone − vienas „up“ ir du „down“ kvarkai), o kvarkus laiko kartu stiprioji branduolio sąveika, perduodama gluonais (kvantinė hromodinamikos — QCD — sritis). Tuo tarpu elektronas nėra sudarytas iš kvarkų — jis priklauso kitai elementariųjų dalelių klasei, vadinamai leptonais.
Šiuolaikiniai atradimai ir technologijos
Per pastaruosius dešimtmečius reikšmingi pasiekimai:
- kvantinės mechanikos ir kvantinės elektrodinamikos tikslūs eksperimentai;
- kvarkų ir gluonų įrodymai bei standartinio modelio formavimasis; Higso bozonas aptiktas 2012 m. LHC (CERN) patvirtino masės mechanizmo dalį;
- to‑level technologijos: atominiai laikrodžiai, lazeriai, spektroskopija, elektroniniai mikroskopai (STM, AFM) leidžia tiesiogiai stebėti atomų elgesį ir manipuliuoti jais;
- branduolinė fizika ir taikymai: energija, medicininės diagnostikos metodikos (pvz., PET, MRI), radioterapija.
Kur taikoma ir kur yra ribos
Atomo teorija yra pagrindinė daugumai fizikinių ir cheminių reiškinių kietuose kūnuose, skysčiuose ir dujose, taip pat suteikia pagrindą plazmos fizikai (jonizuotosios dujos elgsenai). Tačiau egzistuoja ekstremalios terpės, kur tradicinis atomo vaizdas nebetinka:
- Plazma — daugeliu atvejų atomo teorija ir branduolio bei elektronų sąveikų aprašymai vis dar taikomi, bet būtina integruoti jonizaciją ir kolektyvinius elektromagnetinius reiškinius.
- Neutroninės žvaigždės ir kitos itin tankios būsenos — atomai čia yra suspausti ar sunaikinti; materija pereina į degeneruotą neutroninę arba egzotiškesnę būseną, ir tada reikia branduolinės bei dalelių fizikos modelių.
Ateities klausimai
Nors atomų ir subatominių dalelių supratimas yra labai išplėtotas, lieka atviros temos:
- tobulesnis standartinio modelio testavimas ir galimi nukrypimai (pvz., tamsiosios materijos požymiai);
- bandymai susieti kvantinę teoriją su gravitacija;
- arba ar kvarkai ir leptonaigali būti patys elementarūs — tiriama galimybė, kad egzistuoja dar mažesnės struktūros;
- praktiniai įrankiai: atominis valdymas kvantinėms technologijoms, aukštos raiškos spektroskopija ir dalelių greitintuvai atvers dar daugiau žinių.
Apibendrinant: atomo teorija yra dinamiška mokslo sritis, kuri nuo Demokrito filosofinių įžvalgų per Daltono chemines prielaidas ir XX a. kvantinius atradimus atvedė iki šiandieninių sudėtingų modelių, kurie ir toliau plečia mūsų supratimą apie materijos struktūrą.

Demokritas - graikų filosofas, 460 m. pr. m. e.

Roger Joseph Boscovich. Kroatijos jėzuitas, pateikęs atomo teorijos prototipą.

Džonas Daltonas (John Dalton, 1766-1844), anglų chemikas ir fizikas
Seras Josephas Johnas Thomsonas (1856-1940), anglų fizikas, atradęs elektroną ir jo neigiamą krūvį. Jis gavo Nobelio fizikos premiją
Demokrito atomo teorija
Demokritas manė, kad jei ką nors vis perpjausi per pusę, galiausiai teks sustoti. Jis teigė, kad paskutinio materijos gabalėlio neįmanoma sumažinti. Šiuos mažus materijos gabalėlius Demokritas vadino atomais, o tai reiškia "nedalomas". Jis manė, kad atomai išliks amžinai, niekada nesikeis ir negalės būti sunaikinti. Demokritas manė, kad tarp atomų nieko nėra ir kad viską, kas mus supa, būtų galima paaiškinti, jei suprastume, kaip veikia atomai.
Kai kurie kiti filosofai su tuo sutiko, kiti - ne. Jie neturėjo galimybės eksperimentais įrodyti, ar jo teorija teisinga, ar ne.
Boskovičiaus atomo teorija
1758 m. Rodžeris Džozefas Boskovičius aprašė atomo teorijos pirmtaką.
Daltono atomo teorija
1803 m. anglų mokslininkas Džonas Daltonas, gimęs Kamberlande, pertvarkė Demokrito teoriją taip:
- Visa materija sudaryta iš atomų.
- Atomai yra nedalomos ir nematomos dalelės.
- To paties elemento atomai yra tos pačios rūšies ir masės.
- Atomai, sudarantys cheminius junginius, yra tam tikromis proporcijomis.
- Cheminiai pokyčiai susiję su cheminėje reakcijoje dalyvaujančių atomų pertvarkymu.
Daltonas apibrėžė atomą kaip pagrindinį elemento vienetą, galintį dalyvauti cheminiame junginyje.
Thomsono atomo modelis
1850 m. seras Williamas Crookesas sukonstravo "išlydžio vamzdį", t. y. stiklinį vamzdį su pašalintu oru ir metaliniais elektrodais jo galuose, prijungtą prie aukštos įtampos šaltinio. Sukūrus vamzdyje vakuumą, matomas šviesos išlydis, kuris eina nuo katodo (neigiamai įkrauto elektrodo) iki anodo (teigiamai įkrauto elektrodo). Crookesas šią emisiją pavadino "katodiniais spinduliais".
Po katodinių spindulių eksperimentų seras Džozefas Džonas Tomsonas nustatė, kad spindulius skleidžia neigiami krūviai, nes juos traukia teigiamas polius. J. Thomsonas žinojo, kad atomai yra elektriškai neutralūs, tačiau jis nustatė, kad tam atomas turi turėti vienodą neigiamų ir teigiamų krūvių kiekį. Neigiami krūviai buvo pavadinti elektronais (e-).
Remdamasis prielaidomis apie neutralaus krūvio atomus, Tomsonas pasiūlė pirmąjį atomo modelį, kurį apibūdino kaip teigiamai įkrautą sferą, į kurią buvo inkrustuoti elektronai (su neigiamais krūviais). Jis žinomas kaip slyvų pudingo modelis.
1906 m. Robertas Millikanas nustatė, kad elektronų Kulono (C) krūvis yra -1,6 * 10−19, o tai leido apskaičiuoti, kad jų masė yra mažytė, lygi 9,109 * 10 −31kg.
Tuo pat metu 1886 m. Eugene'as Goldsteinas, atlikęs eksperimentus su katodiniais išlydžio vamzdžiais, nustatė, kad teigiamų krūvininkų masė yra 1,6726 * 10 −27kg, o elektros krūvis - +1,6 * 10 C−19. Vėliau lordas Ernestas Rutherfordas šias teigiamai įkrautas daleles pavadino protonais.

Tomsono modelio schema.
Rutherfordo atomo modelis
1910 m. Naujosios Zelandijos fizikas Ernestas Rutherfordas iškėlė idėją, kad teigiami atomo krūviai daugiausia yra atomo centre, branduolyje, o elektronai (e-) - aplink jį.
Rutherfordas tai įrodė, kai alfa spinduliuotės šaltiniu (iš helio) paveikė labai plonus aukso lakštus, apsuptus cinko sulfido lempos gaubto, kuris, veikiamas alfa spinduliuotės, skleidė matomą šviesą. Šis eksperimentas buvo pavadintas Geigerio-Marsdeno eksperimentu arba aukso folijos eksperimentu
Šiuo etapu jau buvo aiškūs pagrindiniai atomo elementai, be to, buvo atrasta, kad elemento atomai gali susidaryti iš izotopų. Izotopai skiriasi branduolio branduolyje esančių neutronų skaičiumi. Nors šis modelis buvo gerai suprantamas, šiuolaikinė fizika vystėsi toliau, ir dabartinių idėjų neįmanoma lengvai suprasti. Tam tikrą idėją apie šiuolaikinę atomo fiziką galima rasti toliau pateiktoje lentelėje esančiose nuorodose.
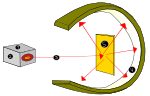
Lordo Ernesto Rutherfordo atominis eksperimentas
Šiuolaikinė fizika
Atomai nėra elementariosios dalelės, nes jie sudaryti iš subatominių dalelių, pavyzdžiui, protonų ir neutronų. Protonai ir neutronai taip pat nėra elementariosios dalelės, nes jie sudaryti iš dar mažesnių dalelių, vadinamų kvarkais, sujungtų kitomis dalelėmis, vadinamomis gliuonais (nes jie "sulipdo" kvarkus atome). Kvarkai yra elementariosios dalelės, nes kvarkų negalima suskaidyti daugiau.
Klausimai ir atsakymai
K: Kas yra atomo teorija?
A: Atomo teorija paaiškina, kaip laikui bėgant keitėsi mūsų supratimas apie atomą.
K.: Kuo kadaise buvo laikomi atomai?
A: Kadaise buvo manoma, kad atomai yra mažiausios medžiagos dalelės.
K: Iš ko iš tikrųjų sudaryti atomai?
A: Atomai sudaryti iš protonų, neutronų ir elektronų.
K: Iš ko sudarytos subatominės dalelės?
A: Subatominės dalelės sudarytos iš kvarkų.
K: Kas yra graikų filosofas, kuris pirmasis sugalvojo atomo idėją?
A: Pirmasis atomo idėją sugalvojo graikų filosofas Demokritas.
K: Kas yra britų chemikas ir fizikas, prisidėjęs prie šiuolaikinės teorijos kūrimo daugybe idėjų?
A: Džonas Daltonas, britų chemikas ir fizikas, prisidėjo prie šiuolaikinės teorijos kūrimo.
Klausimas: Ar atomo teorija taikoma plazmai arba neutroninėms žvaigždėms?
Atsakymas: Teorija taikoma kietiems kūnams, skysčiams ir dujoms, tačiau ji netaikoma analogiškai plazmai ar neutroninėms žvaigždėms.
Ieškoti