Izolobalio analogija organometalinėje chemijoje: sąvoka ir pavyzdžiai
Sužinokite izolobalio analogiją organometalinėje chemijoje: sąvoka, Roald Hoffmann teorija, HOMO/LUMO ryšiai ir aiškūs praktiniai pavyzdžiai.
Izolobalio principas (dar vadinamas izolobalio analogija) – tai teorinis metodas, leidžiantis prognozuoti organometalinių junginių jungimosi ir struktūrinius bruožus, lyginant molekulinius fragmentus pagal jų ribines orbitales. Organometalinėje chemijoje šis principas taikomas organinių ligandų ir neorganinių (dažniausiai pereinamųjų metalų) molekulinių fragmentų tarpusavio analogijai nustatyti: jeigu du fragmentai turi panašias ribines (frontier) orbitales, juos vadiname izobaliniais.
Kas lemia, kad fragmentai yra izobaliniai?
Roaldas Hofmanas (Roald Hoffmann) izobaliniais apibrėžė tuos fragmentus, kuriuose ribinių orbitalių skaičius, simetrijos savybės, apytikslė energija ir forma bei elektronų skaičius yra panašūs – ne identiški, bet pakankamai artimi, kad leistų daryti analogijas. Praktiniai kriterijai dažniausiai apima:
- ribinių orbitalių (HOMO ir LUMO arba vienos reikšmės frontierinės orbitalės) skaičiaus ir užimtumo panašumą,
- orbitalių simetrijos atitikimą, leidžiantį panašiai prisijungti prie kitų fragmentų,
- orbitalių energijų ir formų artimumą, kad tarpusavio sąveikos būtų palyginamos.
Pavyzdžiai
Tipinis izobalinio ryšio pavyzdys – palyginimas tarp paprastų organinių radikalų ir metalinių fragmentų, dažnai išreikštų kaip Fe(CO)3 ar kiti karbiloksidai. Pavyzdžiui, metilo radikalas CH3• dažnai minima kaip izobalinis fragmentas su tam tikrais Fe(CO)3-tipo fragmentais: abu turi panašią vieną ribinę orbitalę, kurioje yra vienas elektronas, ir todėl gali rodyti panašų prisijungimo elgesį. Bendrais bruožais izolobalio analogija leidžia sulyginti:
- organinius radikalus (pvz., CH3•) su metaliniais fragmentais, kuriuose yra netaisyklingas elektronų skaičius ir vienos arba kelių frontierinių orbitalių dalyvavimas,
- karbokationus ar karbanionus su tam tikrais metalų kompleksų fragmentais, turinčiais atitinkamą orbitalinę struktūrą.
Praktinė nauda
Izolobalio analogija yra naudingas intuityvus įrankis, kai reikia:
- numatyti, kaip naujas molekulinis fragmentas gali jungtis prie kitų dalių ar formuoti klasterius,
- suprasti galimą reaktyvumą ir nareagavimo vietas, remiantis geriau žinomų analogų elgsena,
- projektuoti naujus organometalinius junginius ir katalizatorius, perkeldami idėjas iš organinės chemijos į pereinamųjų metalų sritį.
Ribotumai ir kritika
Hoffmannas pats, savo Nobelio premijos paskaitoje, atkreipė dėmesį, kad izolobalio analogija yra paprastas ir veiksmingas modelis, tačiau kartais jis gali būti netikslus. Svarbiausi apribojimai:
- modelis net nemini detalių, kurios lemia orbitalių skilimą dėl stiprių ligandinių laukų ar oksidacijos laipsnių skirtumų;
- neatsižvelgiama į sterinius veiksnius, terpės poveikį, daugiaperskaitines elektronines sąveikas ir kvantinę koreliaciją;
- relatyvistiniai efektai ir specifiniai metalų cheminiai ypatumai gali griauti paprastus analoginius lyginimus.
Dėl šių priežasčių izolobalio principas dažniausiai naudojamas kaip gairė ar pradinė idėja, o galutinė prognozė bei molekulinės struktūros patikra atliekama kvantinės cheminės skaičiavimų ir eksperimentinių metodų pagalba.
Istorija ir pripažinimas
Už įnašą į cheminę teoriją, susijusį su izobaline analogija, 1981 m. Roaldas Hoffmannas buvo apdovanotas Nobelio chemijos premija, kurią jis pasidalijo su Kenichi Fukui. Ši idėja padėjo sujungti organinės ir organometalinės chemijos mąstyseną, suteikdama bendrą kalbą apie orbitalinę struktūrą ir junginių elgseną.
Izolobalinės struktūros grafiškai dažnai vaizduojamos naudojant simbolines orbitalių poras (pvz., dvigalvę rodyklę ir „pusę orbitalės“), kad parodytų, kaip izobalinės poros gali būti sujungtos ar pakeistos — tokie scheminiai piešiniai aiškina, kodėl du, iš pirmo žvilgsnio skirtingi, fragmentai gali turėti panašų jungimosi potencialą ir reaktyvumą.
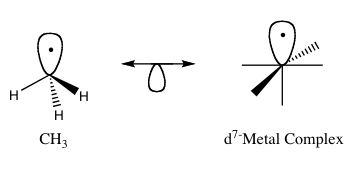
1 pav. 1. Pagrindinis izolobalinės analogijos pavyzdys.
Klausimai ir atsakymai
Klausimas: Kas yra izolobalio principas?
A: Izolobalio principas (dar vadinamas izolobalio analogija) - tai būdas numatyti organometalinių junginių jungimosi savybes. Jis susieja organinių ligandų, galinčių jungtis su neorganinių molekulių fragmentais, struktūrą, lyginant jų didžiausią užimtą molekulinę orbitalę (HOMO) ir mažiausią neužimtą molekulinę orbitalę (LUMO).
K: Kas pasiūlė izolobalio principą?
A: Roaldas Hoffmannas pasiūlė izolobalio principą.
K: Kaip jis susijęs su izoelektroniniais junginiais?
Atsakymas: Izolobaliniai junginiai yra analogiški izoelektroniniams junginiams, kurie turi tą patį valentinių elektronų skaičių ir tą pačią struktūrą.
Klausimas: Ką Hoffmannas gavo už darbą, susijusį su šia koncepcija?
A.: Už darbą, susijusį su izoliobalų analogija, 1981 m. Hoffmannui buvo paskirta Nobelio chemijos premija, kurią jis pasidalijo su Kenichi Fukui.
K: Kaip Hoffmannas apibūdino molekulinius fragmentus?
A: Hoffmannas molekulinius fragmentus apibūdino kaip izolobalinius, "jei ribinių orbitalių skaičius, simetrijos savybės, apytikslė energija ir forma bei elektronų skaičius jose yra panašūs - ne identiški, bet panašūs".
Klausimas: Kaip šį modelį galima naudoti, norint numatyti jungimąsi ir reaktyvumą?
Atsakymas: Mažiau žinomų dalių jungimąsi ir reaktyvumą galima nuspėti pagal geriau žinomų dalių jungimąsi ir reaktyvumą, jei jų ribinės orbitalės yra panašios.
K: Ar šis modelis visada veikia teisingai?
Atsakymas: Ne, tam tikrais atvejais jis neveikia.
Ieškoti