Antrasis termodinamikos dėsnis: entropija, prasmė ir pavyzdžiai
Suvokite antrąjį termodinamikos dėsnį: kas yra entropija, jos prasmė, praktiniai pavyzdžiai ir kas lemia energijos sklaidą uždarose sistemose.
Antrasis termodinamikos dėsnis apibrėžia kryptį, kuria vyksta natūralūs procesai: izoliuotoje (uždaroje ir nekeičiant energijos) sistemoje bendra entropija paprastai didėja arba lieka pastovi, bet niekada ne mažėja. Tai reiškia, kad energija ir materija linksta paskirstytis kuo tolygiau — procesai, kurie didina netvarką arba galimų mikrovalstybių skaičių, yra daug labiau tikėtini.
Kas yra entropija?
Entropija — tai matas, rodantis, kiek skirtingų mikroskopinių būsenų atitinka tą pačią makroskopinę būseną. Paprastai entropiją galima suprasti kaip materijos ir energijos plitimo gebėjimo matą: didėjant entropijai, energija „išsilieja“ daugiau galimų būdų, kaip ją paskirstyti.
Matematiškai Bolcmano formulė ryškiai tai išreiškia: S = k ln W, kur S – entropija, k – Bolcmano konstanta (k ≈ 1,380649·10−23 J/K), W – mikroskopinių būsenų skaičius. Entropijos vienetas: J/K (džauliai vienam kelvinui).
Formuluotės ir ekvivalentinės išraiškos
Dažniausiai antrasis termodinamikos dėsnis formuluojamas keliais lygiaverčiais teiginiais. Vienas iš klasikinių suformulavimų, priskiriamas Rudolfo Klauziuso:
Šiluma pati savaime negali pereiti iš šaltesnio kūno į karštesnį.
Lygiavertis lordo Kelvino teiginys:
Transformacija, kurios vienintelis galutinis rezultatas yra iš pastovios temperatūros šaltinio paimtą šilumą paversti darbu, yra neįmanoma.
Abi formuluotės reiškia: negalima sukonstruoti amžino veiksmo mašinos, kuri be papildomų sąlygų visą šilumą paverstų darbu. Kitais žodžiais, tam tikri procesai (šilumos tekėjimas iš karšto į šaltą ir pan.) yra nesugrįžtami arba reikalauja bendros entropijos padidėjimo.
Matematika trumpai
Entropijos pokytis cheminėje ar termodinaminėje sistemoje, kai sistema gauna mažą kiekį atgalinio proceso šilumos dQrev, aprašomas lygtimi:
ΔS = ∫ dQrev / T
Izoliuotai sistemai (be energijos mainų su aplinka) antrasis dėsnis užrašo paprastą netolygumą:
ΔS ≥ 0
čia ΔS yra visos sistemos entropijos pokytis. Lygi nuliui (ΔS = 0) tik idealizuotuose atvejuose — visiškai reversiškose (grįžtamosiose) transformacijose.
Pavyzdžiai iš kasdienybės ir praktikos
- Karštas puodelis kavos atvėsta: šiluma pereina iš kavos į aplinkos orą, bendra entropija padidėja.
- Ledas tirpsta vandenyje: vietoje griežtos, mažiausios entropijos būsenos (tvarkinga ledinė struktūra) gaunama didesnė entropija (skysta vandens būsena su daugiau galimybių molekulių išsidėstymui).
- Du skirtingų temperatūrų skysčiai sumaišomi — galiausiai temperatūra pasiskirsto tolygiai, o entropija padidėja. Net jeigu vietiškai kažkas tampa tvarkingesnis, bendras entropijos pokytis yra teigiamas.
- Du galiausiai susijungiantys dujiniai tūriai: laisvas dujų išsiplėtimas į vakuumą padidina entropiją (procesas negrįžtamas be papildomo darbo).
- Šaldytuvas iš pirmo žvilgsnio sumažina šalia esančios kameros entropiją, bet jam veikti reikia elektros energijos — bendrame visatos entropijos balanse entropija padidėja.
Apribojimai ir statistinė prasmė
Antrasis dėsnis nėra absoliutus deterministinis draudimas kiekvienam mikroskopiniam įvykiui; jis yra statistinis dėsnis, taikomas dideliam atomų ir molekulių skaičiui. Mažuose (mikroskopiniuose) sistemas atsitiktinai įmanomi vietiniai entropijos sumažėjimai, tačiau didelėse sistemos dalyse tokie atsitiktiniai sumažėjimai yra praktiškai neįtikėtini.
Todėl pasakymas „viskas stengiasi išlaikyti tą pačią temperatūrą“ yra supaprastintas; teisingiau sakyti, kad energijos pasiskirstymas linksta labiau tikėtinų, aukštesnės entropijos būsenų link — dažnai tai reiškia temperatūrų suvienodėjimą, bet antrasis dėsnis reiškia platesnį tendencijų rinkinį, susijusį su grįžtamumu ir energijos kokybe.
Praktinė reikšmė
Antrasis dėsnis lemia, kad visos šilumos variklių, variklių ir energetikos technologijos turi ribotą naudingumo koeficientą, negalintį viršyti idealių (Carnoto) ribų, kurios priklauso nuo karštų ir šaltų šaltinių temperatūrų. Taip pat jis paaiškina procesų nesugrįžtamumą, mišinių maišymą, savybes termodinaminėse cheminėse reakcijose bei informacijos teorijoje entropijos sąvokos ryšį su netvarka ir nežinomybe.
Santrauka
Antrasis termodinamikos dėsnis — tai galinga teorinė priemonė, kuri statistiniu požiūriu paaiškina, kodėl tam tikri procesai vyksta vienu kryptimi, kodėl neįmanomas amžinas variklis ir kaip matuoti sistemos „netvarką“ per entropiją. Lokaliai entropijos mažėjimai yra įmanomi, tačiau jie visuomet reikalauja energijos arba lemia didesnį entropijos padidėjimą kažkur kitur.
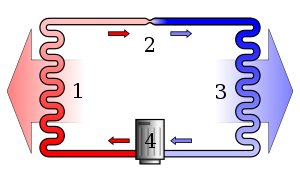
Paprasta stilizuota šilumos siurblio garų suspaudimo šaldymo ciklo schema: 1) kondensatorius, 2) išsiplėtimo vožtuvas, 3) garintuvas, 4) kompresorius.
Apžvalga
Bendrąja prasme antrasis dėsnis teigia, kad temperatūrų skirtumai tarp tarpusavyje besiliečiančių sistemų turi tendenciją išsilyginti ir kad iš šių nevienodų temperatūrų skirtumų galima gauti darbą, tačiau, atliekant darbą ir didėjant entropijai, prarandama šiluminė energija. Slėgio, tankio ir temperatūros skirtumai izoliuotoje sistemoje yra linkę susilyginti, jei tik yra galimybė; tankiui ir slėgiui, bet ne temperatūrai, turi įtakos gravitacija. Šiluminis variklis yra mechaninis įrenginys, kuris atlieka naudingą darbą dėl dviejų kūnų temperatūrų skirtumo.
Citatos
| " | Dėsnis, kad entropija visada didėja, manau, užima aukščiausią vietą tarp gamtos dėsnių. Jei kas nors jums nurodys, kad jūsų mėgstama visatos teorija nesutampa su Maksvelo lygtimis - tuo blogiau Maksvelo lygtims. Jei paaiškėja, kad joms prieštarauja stebėjimai - ką gi, eksperimentatoriai kartais suklysta. Bet jei paaiškės, kad jūsų teorija prieštarauja antrajam termodinamikos dėsniui, negaliu jums suteikti jokios vilties; jai nelieka nieko kito, kaip tik žlugti giliausiame nusižeminime. | " |
-Sir Arthur Stanley Eddington, "Fizikinio pasaulio prigimtis" (1927)
| " | Entropijos didėjimo tendencija izoliuotose sistemose išreiškiama antruoju termodinamikos dėsniu - bene pesimistiškiausia ir amoraliausia visos žmonijos minties formuluote. | " |
--Greg Hill ir Kerry Thornley, Principia Discordia (1965)
| " | Antrojo dėsnio formuluočių yra beveik tiek pat, kiek ir diskusijų apie jį. | " |
--Filosofas ir fizikas P. W. Bridgmanas, (1941)
Įvairūs
- Flandersas ir Swannas sukūrė Antrojo termodinamikos dėsnio teiginio muzikinį apipavidalinimą, pavadintą "Pirmasis ir antrasis dėsnis.
- Ekonomistas Nicholas Georgescu-Roegenas atskleidė entropijos dėsnio reikšmę ekonomikos srityje (žr. jo darbą "Entropijos dėsnis ir ekonominis procesas" (The Entropy Law and the Economic Process, 1971), Harvard University Press).
Klausimai ir atsakymai
K: Koks yra antrasis termodinamikos dėsnis?
A: Antrasis termodinamikos dėsnis teigia, kad kai energija iš vienos formos pereina į kitą arba materija laisvai juda, uždaroje sistemoje didėja entropija (netvarka).
K: Kas laikui bėgant turi tendenciją horizontaliai išsilyginti?
A: Temperatūros, slėgio ir tankio skirtumai po kurio laiko horizontaliai išsilygina.
K: Kodėl tankis ir slėgis neišsilygina vertikaliai?
A: Dėl gravitacijos jėgos tankis ir slėgis vertikaliai neišsilygina. Tankis ir slėgis apačioje bus didesnis nei viršuje.
K: Kas yra entropija?
A: Entropija yra materijos ir energijos sklaidos visur, kur jos gali patekti, matas.
K: Kaip dažniausiai formuluojamas antrasis termodinamikos dėsnis?
A: Dažniausiai antrasis termodinamikos dėsnis iš esmės suformuluotas Rudolfo Klauzijaus dėka: viskas stengiasi išlaikyti tą pačią temperatūrą per tam tikrą laiką.
K: Koks dar vienas Klauzijaus teiginys apie antrąjį termodinamikos dėsnį?
A: Kitas Klauzijaus teiginys yra tas, kad šiluma savaime negali pereiti iš šaltesnio kūno į karštesnį.
K: Kokiai sistemai taikomas antrasis termodinamikos dėsnis?
A: Antrasis termodinamikos dėsnis taikomas tik didelėms sistemoms, į kurias energija ar medžiaga nepatenka ir iš kurių neišeina. Kuo didesnė sistema, tuo didesnė tikimybė, kad antrasis dėsnis bus teisingas.
Ieškoti