Enoliai: apibrėžimas, struktūra, tautomerija ir reakcijos
Sužinokite, kas yra enoliai, jų struktūra, enolio–keto tautomerija, sintezė ir pagrindinės reakcijos (aldolis, kinetiniai ir termodinaminiai enolatai) — aiškiai ir išsamiai.
Apibrėžimas ir pagrindinė struktūra
Enolis - tai alkenas, kurio viename dvigubos jungties gale yra OH grupė (taip pat dažnai vadinamas vinyliniais alkoholiais). Enolatu, jei deguonies atomo protonas yra atimtas — gaunama O⁻ forma, kuri dažnai egzistuoja kaip metalo kationo kompleksiškas junginys (pavyzdžiui, natrio ar litio enolatai). Enolų struktūra apibrėžiama C=C–OH fragmentu; enolatai yra rezonansiniai su C–O⁻ forma, todėl jų elektroninė struktūra lemia reaktyvumą.
Tautomerija: keto–enolio pusiausvyra
Enolai yra ketonų arba aldehidų tautomerai. Tautomerai - tai molekulės, kurios skiriasi tik vandenilio atomo padėtimi. Tautomerizmas vyksta per protono pernašą: dažniausiai angliavandenilio alfa vandenilis perkeliamas iš anglies prie deguonies arba atvirkščiai. Daugumai paprastų ketonų ir aldehidų keto forma yra termodinamiškai stabilesnė, nes C=O ryšys yra stipresnis už C=C ryšį, todėl pusiausvyra dažnai krypsta link ketono. Tačiau yra išimčių: jei enolio forma yra stabilizuota intramolekuliniu vandenilio ryšiu, aromatinės konjugacijos ar rezonansine delokalizacija (pvz., β‑diketonai, fenoliškos sistemos), enolio dalis gali būti dominuojanti.
Enolių formavimas
Enolius ir enolatus galima gauti keliais pagrindiniais būdais:
- Bazinė enolizacija: stipri bazė (pvz., hidroxidas, alkoksidas arba steriškai didelės bazės kaip LDA) atima alfa protoną, susidaro enolatas. Tai dažniausiai naudojamas kelias į enolatus ir jų tolesnę alkilinimą ar kondensaciją.
- Rūgštinė enolizacija: karbonilo deguonis protonuojamas, dėl to alfa vandenilis tampa labiau acidiškas ir gali būti atimtas, susidarant enoliui. Šis kelias vyksta lėčiau ir yra reversiškas.
- Funkcinių grupių transformacijos: pavyzdžiui, sintezėje naudojami silylinių enolių eteriai (silyl enol ethers) kaip enolių ekvivalentai; jie saugesni ir selektyvesni tam tikroms reakcijoms.
Kinetiniai ir termodinaminiai enolatai
Ketonų enoliai gali būti gaminami iš dviejų skirtingų pusių (skirtingi alfa angliai). Svarbu mokėti pasirinkti, kurioje pusėje reaguoti. Lengviausia reaguoti su mažiau pakaitų turinčia puse: ją galima pagaminti esant žemai temperatūrai su stambia baze. Ši pusė vadinama kinetiniu enolatu — jis susidaro greičiau, bet nebūtinai yra stabilesnis. Kita pusė, turinti daugiau pakaitų, reaguoja sunkiau. Reikia aukštesnės temperatūros. Ji vadinama termodinaminiu enolatu — jis yra stabiliausias ir dominuoja, kai sistema pasiekia pusiausvyrą.
Pavyzdžiui, naudojant LDA (ličio diizopropilamidot) žemoje temperatūroje (pvz., −78 °C) gaunamas kinetinis enolatas, o veikiant silpnesnėmis bazėmis arba kaitinant — termodinaminis enolatas.
Enolių ir enolatų reaktvumas
Enolatai yra ambidentiniai nukleofilai: jie gali reaguoti per deguonies atomą (O‑alkilinimas) arba per alfa anglies atomą (C‑alkilinimas). Reakcijos selektyvumą lemia reagentai ir sąlygos. Praktinės ir svarbios reakcijos:
- Aldolio reakcija: enolato nukleofilas atakuoja kitą karbonilą, sudarant β‑hydroxy karbonilą, kuris gali dehidruoti iki α,β‑neneso junginio.
- Alkilinimas: enolatai (ar jų ekvivalentai) alkilinti leidžia formuoti naujus C–C ryšius alfa padėtyje.
- Halogeninimas: enoliai/enolatai reaguoja su halogenais alfa pozicijoje (pvz., monochlorinimas ar brominimas).
- Michael papildymas: nukleofiliniai enolatai atakuoja α,β‑neneso karbonilus (konjuguoti papildymai).
- O‑ar C‑alkilinimo kontrolė: naudojant tinkamus katalizatorius ar apsaugančias grupes (pvz., silyl enol ethers), galima pasirinkti norimą produktą.
Stabilumo veiksniai ir praktiniai pastebėjimai
- Resonansinė stabilizacija: enolatai yra rezonansuojami — neigiama krūvis delokalizuojamas ant deguonies ir alfa anglies, todėl enolatai dažnai yra stabilūs mažesniam krūviui prilygstančioje formoje.
- Vandenilio ryšys: intramolekulinis vandenilio ryšys (pvz., β‑diketonai) gali labai stabilizuoti enolio formą, todėl tautomerizmas gali krypsti link enolio.
- Konjugacija: jei enolio dvigubasis ryšys konjuguotas su aromatine sistema ar kitomis elektronegatyviomis grupėmis, enolio forma gali būti reikšmingesnė.
- pKa ir rūgštumas: alfa vandeniliai prie karbonilo yra palyginti acidiški (dėl enoliato stabilizacijos), todėl juos gana lengva nukleofiliškai atimti tinkamomis bazėmis.
Išvados
Enoliai ir enolatai yra kertinės organinės chemijos tarpprodukinių ir reakcinių vienetų, ypač svarbūs C–C jungčių formavimui ir funkcinėms transformacijoms. Tinkamai parinkus katalizatorius, bazes ir temperatūrą, galima valdyti enolinės chemijos selektyvumą — įskaitant kinetinio arba termodinamino enolato gavimą, C‑ arba O‑alkilinimą bei kitas svarbias reakcijas (aldolio, Michael ir pan.).
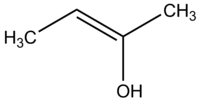
Enol
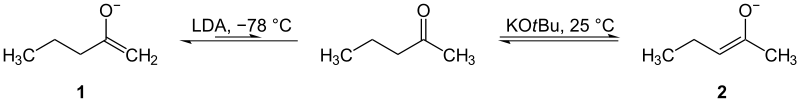
Kinetiniai (1) ir termodinaminiai (2) enolatai
Klausimai ir atsakymai
K: Kas yra enol?
Atsakymas: Enolis yra alkenas, kurio viename dvigubos jungties gale yra OH grupė.
K: Kas yra enolatas?
Atsakymas: Enolatas yra enolis, kurio deguonies atomo protonas pašalintas.
K: Kas yra tautomerai?
A: Tautomerai - tai molekulės, kurios skiriasi tik vandenilio atomo padėtimi.
K: Kaip iš ketonų arba aldehidų galima pagaminti enolį?
A: Enolius galima lengvai pagaminti iš ketonų ar aldehidų naudojant bazę.
K: Kodėl enoliai yra nestabilūs?
A: Enolai yra nestabilūs, nes C=O ryšys yra stipresnis už C=C ryšį.
K: Kas yra aldolio reakcija?
A: Aldolio reakcija yra įdomi reakcija, kurią galima atlikti su enoliais.
K: Kaip galima reakcijai paruošti enolo pusę, kurioje yra mažiau substituentų?
A: Enolio pusė, turinti mažiau pakaitų, vadinama kinetiniu enolatu, gali būti gaminama žemoje temperatūroje su stambia baze reakcijai.
Ieškoti