Molekulė: apibrėžimas, struktūra, savybės ir pavyzdžiai
Molekulė: išsamus apibrėžimas, struktūra, savybės ir pavyzdžiai — suprantamai apie atomų jungtis, molekulines formas (C6H12O6), medžiagų būsenas ir taikymą chemijoje.
Molekulė yra mažiausias galintis egzistuoti cheminės medžiagos kiekis, kuris išlaiko tos medžiagos chemines savybes. Jei molekulė būtų suskaidyta į mažesnius gabalėlius, gaunami nauji atomai ar grupės, ir tai gali reikšti, kad gaunama kita medžiaga ar naujos savybės.
Struktūra ir jungtys
Molekulės susidaro iš tam tikros formos ar pavidalo tarpusavyje susijungusių atomų. Atomai susijungia dėl įvairių cheminių jungčių, iš kurių dažniausios yra kovalentinės (bendrų elektronų porų dalijimasis) ir koordinacinės jungtys. Ne visi atomų deriniai yra vienodai įmanomi — tam įtakos turi atomų elektroninė struktūra ir valentingumas (tendencija formuoti tam tikrą jungčių skaičių). Pavyzdžiui, deguonies atomai paprastai formuoja dvi jungtis su kitais atomais, anglies atomai dažnai turi keturias jungtis, o azoto atomai dažniausiai turi tris jungtis (tačiau yra išimčių ir oksidacijos laipsnių skirtumų).
Be to, atomai gali formuoti įvairias struktūras: paprastas dviatomes molekules (pvz., O2), lankstesnes poliatomines molekules (pvz., H2O) arba dideles organines molekules ir makromolekules (pvz., baltymus, polisacharidus). Molekulės forma (molekulinė geometrija) lemia jų fizines ir chemines savybes; ją apibūdina teorijos, pvz., VSEPR, ir kvantinė molekulinė orbitalinė teorija.
Molekulinės formulės ir užrašai
Naudodami molekulinę formulę galite užrašyti visų molekulėje esančių atomų skaičių. Pavyzdžiui, gliukozės molekulinė formulė yra C6H12O6. Tai reiškia, kad vieną gliukozės molekulę sudaro šeši anglies atomai, dvylika vandenilio atomų ir šeši deguonies atomai. Be grynos molekulinės formulės, chemijoje dažnai naudojamos:
- Empirinė formulė — mažiausias sveikųjų skaičių santykis tarp atomų (pvz., CH2 vietoje C6H12O6).
- Struktūrinė formulė — rodo, kaip atomai yra susijungę tarpusavyje ir kokios jungtys egzistuoja.
Fizinės būsenos ir molekulių judėjimas
Kinetinėje dujų teorijoje terminas molekulė dažnai vartojamas bet kuriai dujų dalelei, nepriklausomai nuo jos sudėties. Pagal šį apibrėžimą molekulėmis laikomi tauriųjų dujų atomai, nes jie iš tikrųjų yra monoatominės molekulės (vieno atomo dalelės). Tačiau praktikoje molekulių elgsena skiriasi priklausomai nuo medžiagos būsenos:
- Dujos: tokiose dujose kaip oras molekulės juda laisvai ir retai sąveikauja ilgiau nei trumpas susidūrimas.
- Skysčiai: pavyzdžiui, vandenyje, molekulės yra tarpusavyje pritraukiamos ir sudaro trumpalaikes struktūras, bet vis tiek gali slinkti viena pro kitą.
- Kietosios medžiagos: tokiose kaip cukrus, molekulės dažnai yra išdėstytos tvarkingai tinklelyje ir gali tik vibruoti aplink pusiausvyros padėtį.
- Plazma: ketvirtoje materijos būsenoje, vadinamoje plazma, atomai yra jonizuoti ir dėl to negali formuoti stabilų molekulių tinklą.
Tarpmolekulinės sąveikos ir savybės
Molekulių elgesį ir medžiagų savybes lemia ne tik cheminės jungtys viduje molekulės, bet ir tarpmolekulinės jėgos. Jas sudaro Van der Waals (dispersinės) jėgos, dipolio–dipolio sąveikos ir vandenilinės jungtys. Tarpmolekulinės sąveikos stiprumas įtakoja medžiagų lydymosi ir virimo temperatūras, garavimą, tirpumą ir klampumą.
Molekulių poliarumas priklauso nuo jungčių poliarumo ir molekulinės geometrijos — polinės molekulės lengviau tirpsta poliniuose tirpikliuose (pvz., vanduo), o nepolinės molekulės geriau tirpsta nepoliniuose tirpikliuose (pvz., aliejus).
Specifinės savybės ir cheminė reaktvybė
Molekulės turi chemines savybes, kurios priklauso nuo jų funkcinių grupių, elektroninės sandaros ir erdvinės struktūros. Organiziniuose junginiuose funkcinių grupių buvimas (pvz., hidroksilo, karboksilo, amino grupės) nulemia reakcijų tipus, kuriuos molekulė gali patirti. Taip pat svarbios sąvokos: izomerija (ta pati molekulinė formulė, bet skirtinga struktūra), rezonansas, kitimo mechanizmai ir aktyvios vietos (ypač biochemijoje).
Molekulinės savybės kiekiais ir matavimas
Kiekviena molekulė turi tam tikrą molekulinę (molinę) masę, išreikštą atominėmis masės vienetų sumomis, o medžiagų kiekiai chemijoje matuojami moliais (Avogadro skaičius ~6,022·10^23 dalelių viename mole). Molekulės savybes nustatyti padeda instrumentiniai metodai: spektroskopija (IR, NMR, UV–Vis), masių spektrometrija, rentgeno kristalografija ir kt.
Pavyzdžiai ir išimtys
Tipiniai molekulių pavyzdžiai: vanduo (H2O), deguonis (O2), azotas (N2), anglies dioksidas (CO2), gliukozė (C6H12O6). Tuo tarpu kai kurios medžiagos, pavyzdžiui, druskos (pvz., NaCl), formuoja joninius tinklus, o ne atskiras molekules — todėl jas kartais nereikėtų vadinti „molekulėmis“ tradicine prasme. Metalai taip pat sudaro bendrą elektroninį tinklą, o ne diskrečias molekules.
Reikšmė gamtoje ir technologijose
Molekulės yra pagrindinis gyvybės ir cheminių procesų statybinis blokas: nuo DNR ir baltymų biologijoje iki vaistų, polimerų ir kuro pramonėje. Molekulių supratimas leidžia kurti naujas medžiagas, optimizuoti reakcijas ir tirti biologinius mechanizmus.
Apibendrinant: molekulė yra struktūriškai ir cheminėmis savybėmis apibrėžta atomų sankaupa. Jos forma, jungtys ir tarpmolekulinės sąveikos lemia medžiagų savybes bei jų elgseną įvairiose sąlygose.
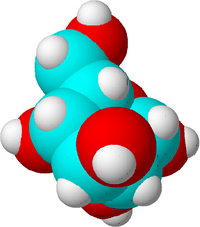
Tai cukraus molekulė. Anglies atomai pažymėti mėlynai, deguonies atomai - raudonai, o vandenilio atomai - baltai, kad būtų matyti skirtumas. Iš tikrųjų atomai neturi spalvos.
Klijavimas
Kad molekulė egzistuotų, atomai turi sukibti tarpusavyje. Taip atsitinka, kai du atomai dalijasi elektronais. Vietoj to, kad elektronas skrieja aplink vieną atomą, dabar jis skrieja aplink du. Tai vadinama kovalentiniu ryšiu. Kartais dalijamasi daugiau nei vienu elektronu. Kuo daugiau elektronų pasidalijama, tuo stipresnis ryšys ir tuo stipriau atomai laikosi kartu.
Ryšiai taip pat gali nutrūkti. Kadangi daugumai ryšių susidaryti reikia energijos, jie taip pat atiduoda energiją, kai nutrūksta. Tačiau prieš nutraukiant daugumą ryšių molekulė turi būti įkaitinta. Tuomet atomai pradeda judėti, o kai jie juda per daug, ryšys nutrūksta. Molekulės, kurioms suardyti reikia mažiau energijos, nei jos atiduoda suardytos, vadinamos degalais. Pavyzdžiui, žvakė tiesiog sėdi ir nieko nevyksta. Tačiau kai ją uždegsite degtuku, ji ilgai degs. Degtukas suteikia energijos pirmiesiems ryšiams nutraukti, o šie išskiria pakankamai energijos, kad nutrūktų žemiau esantys ryšiai, kol žvakė sudegs.
Taip pat yra joninių ryšių.
Klausimai ir atsakymai
K: Kas yra molekulė?
A: Molekulė yra mažiausias galimas cheminės medžiagos kiekis. Jį sudaro tam tikros formos ar pavidalo vienas prie kito prijungti atomai.
K: Kiek ryšių turi deguonies, anglies ir azoto atomai?
A: Deguonies atomai visada turi dvi jungtis su kitais atomais, anglies atomai visada turi keturias jungtis su kitais atomais, o azoto atomai visada turi tris jungtis su kitais atomais.
K: Ką kinetinė dujų teorija sako apie molekules?
Atsakymas: Pagal dujų kinetinę teoriją molekule dažnai vadinamos visos dujų dalelės, neatsižvelgiant į jų sudėtį. Tai reiškia, kad tauriųjų dujų atomai laikomi molekulėmis, nes jie iš tikrųjų yra vienatomės molekulės.
K: Kaip molekulės elgiasi skirtingose būsenose?
A: Tokiose dujose kaip oras molekulės tiesiog skraido. Skysčiuose, pavyzdžiui, vandenyje, molekulės yra sulipusios, bet vis tiek gali judėti. Kietosiose medžiagose, pavyzdžiui, cukraus, molekulės gali tik vibruoti. Plazmoje (ketvirtoji materijos būsena) atomai yra jonizuoti ir negali sudaryti molekulių.
K: Kokia yra molekulinė formulė?
Atsakymas: Molekulinė formulė naudojama visų molekulėje esančių atomų skaičiams užrašyti. Pavyzdžiui, C6H12O6 reiškia vieną gliukozės molekulę, kurią sudaro šeši anglies atomai, dvylika vandenilio atomų ir šeši deguonies atomai.
Ieškoti