Vienišoji elektronų pora: reikšmė, savybės ir molekulinė įtaka
Vienišoji elektronų pora: sužinokite apie jos savybes, poveikį molekulių geometrijai, reaktyvumą ir vaidmenį cheminėse reakcijose.
Vienišoji pora – tai dviejų elektronų grupė, kuri nenaudojama jokiame ryšyje tarp atomų. Tokios poros paprastai yra paskutiniame atomo apvalkale – valentiniame apvalkale – ir, kartu su jungiamaisiais elektronais, sudaro bendrą valentinių elektronų skaičių. Vienišos poros laikomos „nebendravimo“ (nonbonding) elektronais: jų energija ir erdvinės savybės skiriasi nuo jungiamųjų elektronų ir jos dažnai lemia molekulės elgesį bei chemines savybes.
Savybės ir elgsena
- Erdvinis pasiskirstymas. Vienišos poros užima daugiau vietos aplink atomą nei jungiančios elektronų poros. Dėl didesnio elektronų tankio jos sukelia didesnį atstūmimą kitoms elektronų poroms (VSEPR principas), kas pakeičia cheminio junginio geometriją.
- Energetinis lygis ir reaktivumas. Vienišos poros gali turėti aukštesnę arba žemesnę energiją priklausomai nuo atomo tipo ir aplinkos; dažnai jos yra labiau reaguojančios nei jungiamieji elektronai ir dalyvauja cheminėse reakcijose kaip elektronų donorai.
- Hibridizacija ir orbitalės pobūdis. Vienišos poros gali būti „sudėtos“ į skirtingas orbitales (pvz., sp3, sp2, p). Hibridizacija lemia tiek poros geometriją, tiek energiją: pvz., sp3 vienišoji pora būna didesnės erdvinės aprėpties nei p tipo pora.
- Delokalizacija. Kai vienišoji pora dalyvauja rezonanso ar konjugacijos sistemoje, ji gali būti delokalizuota per π-sistemą. Tokia delokalizacija mažina poros energetinį lygį ir pakeičia molekulės reaktyvumą (pvz., anilino azoto vienišoji pora dalinasi su benzeno žiedu ir dėl to mažiau reaguoja su protonais).
Įtaka molekulės formai ir fizikinėms savybėms
Vienišos poros stipriai veikia molekulės geometriją. Pagal VSEPR teoriją, elektronų poros (jungiančios ir vienišos) išsidėsto taip, kad atstumtų viena kitą kuo labiau. Todėl atomas su vienišomis poromis formuoja kampus, kurie skiriasi nuo idealių geometrinių kampų. Pavyzdžiai:
- Vanduo (H2O): deguonies atome yra dvi vienišos poros – molekulė tampa „įlinkusi“ (kampas apie 104,5°).
- Amoniakas (NH3): vienišoji pora azoto atome lemia piramidės formą (kampas apie 107°).
Be to, vienišos poros yra svarbios vandenilinių jungčių susidarymui: jos gali veikti kaip H-acceptoriai, kas stipriai įtakoja tirpumą, virimo temperatūrą ir kt.
Cheminis reikšmingumas
Vienišos poros dažnai dalyvauja cheminėse reakcijose:
- Nukleofilinis aktyvumas. Nukleofilai paprastai turi vienišą porą, kurią naudoja elektrofilui atakuoti ir suformuoti naują ryšį. Tai pagrindinis mechanizmas daugelyje organinių reakcijų.
- Lewis pagrindai ir koordinacija. Vienišos poros leidžia atomams veikti kaip Lewis bazės – jos gali atiduoti elektronų porą metalams ar kitoms elektronų priimančioms centrinėms dalelėms, sudarydamos koordinacinius (datyvuosius) ryšius.
- Acidobazinis elgesys. Atomo gebėjimas atiduoti vienišą porą lemia jo bazines savybes (pvz., azoto bazinimas). Delokalizuotos vienišos poros paprastai yra mažiau nukleofilinės ir mažiau baziškos.
Moksliniai metodai ir stebėjimas
Vienišos poros tiriamos ir eksperimentiniu, ir teoriniu būdu. Spektroskopiniai metodai (pvz., infraraudonųjų spindulių spektroskopija, rentgeno kristalografija, fotoelektroniniai tyrimai) ir skaičiavimai (pvz., kvantinė chemija, NBO analizė, elektronų tankio žemėlapiai) leidžia nustatyti vienišųjų porų vietą, energiją ir jų poveikį molekulės savybėms.
Santrauka
Vienišoji elektronų pora – svarbi cheminių ir fizinių savybių priežastis: ji lemia molekulės geometriją, reaktyvumą, vandenilinių jungčių formavimą ir koordinacinę chemiją. Supratimas, kur ir kaip elgiasi vienišos poros (įskaitant jų hibridizaciją, delokalizaciją ir erdvinį poveikį), yra būtinas tiek organinei, tiek neorganinei chemijai, biochemijai ir medžiagų mokslui.
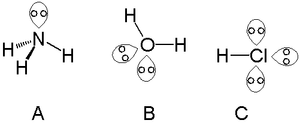
Vienišos poros amoniake (A), vandenyje (B) ir druskos rūgštyje (C)
Ieškoti