Elektrofilas: apibrėžimas, vaidmuo ir pavyzdžiai chemijoje
Elektrofilas: aiškus apibrėžimas, vaidmuo ir praktiški pavyzdžiai chemijoje — sužinokite, kas atakuoja nukleofilus ir kaip vyksta adityvinės bei oksidacinės reakcijos.
Chemijoje elektrofilas - tai molekulė arba atomas, kuris mielai priima elektronus iš kitos molekulės arba atomo. Daugelis elektrofilų turi teigiamą krūvį. Jie dar vadinami Lewiso rūgštimis. Kai kurie elektrofilų pavyzdžiai yra molekulės, kurių atomų elektroneigiamumas labai skiriasi, pavyzdžiui, HCl arba karbonilas, taip pat oksidatoriai.
Elektrofilus atakuoja nukleofilai, t. y. priešingos rūšies molekulės. Taip atsitinka, pavyzdžiui, adityvinėse reakcijose.
Kas lemia elektrofilumo stiprumą?
Elektrofilumo laipsnį nulemia keli veiksniai:
- Teigiamas arba dalinis teigiamas krūvis – geras elektrofilas dažnai turi pilną arba dalinį + krūvį (pvz., karbokationas), todėl natūraliai siekia elektronų poros.
- Elektroneigiamumo skirtumai ir polarizacija – kai jungtinio atomai turi didelius elektroneigiamumo skirtumus, vienas iš atomų tampa dalinai teigiamu (pvz., H–Cl), todėl gali elgtis kaip elektrofilas.
- Rezonavimas ir konjugacija – rezonuojančiai stabilizuotas centras gali būti mažiau reaguojantis arba, atvirkščiai, tam tikrose struktūrose pritraukti nukleofilų (priklauso nuo situacijos).
- Indukciniai efektai – elektronus atitraukiančios grupės (EWG) didina gretimo centro elektrofilumą.
- Solvento ir temperatūros poveikis – poliarūs tirpikliai stabilizuoja joninius tarpininkus ir gali keisti reakcijos greitį bei selektyvumą.
Pagrindinės elektrofilinių reakcijų rūšys
- Elektrofilinė adicija – tipinė reakcija su alkenais: elektrofilas pirmiausia prisijungia prie dvigubos jungties, susidaro tarpinis jonas, kurį vėliau užgrobia nukleofilas. Pvz., Br2 arba HBr su alkenais.
- Elektrofilinė aromatinė substitucija (EAS) – aromatinis žiedas atakuoja stiprų elektrofilą (pvz., nitroniį NO2+ nitracijos metu), susidaro σ-kompleksas, o vėliau atstatomas aromatiškumas atmetant protoną.
- Friedel–Crafts acilacija/alkilinimas – katalizatoriai kaip AlCl3 suformuoja acilio arba alkilio kationus (aktyvūs elektrofilai), kurie atakuoja aromatinį žiedą.
- Aciletravimas ir nukleofilinės atakos į karbonilus – karbonilo anglis (karbonilas) yra elektrofilinis centras dėl deguonies atitraukiančio poveikio ir dažnai atakuojamas nukleofilų.
Pavyzdžiai elektrofilių
- HCl – protonas (H+) elgiasi kaip stiprus elektrofilas.
- Halogenai, pvz., Br2 – poliarizuodami gali veikti kaip elektrofilai alkenų adicijoje.
- Karbonilų anglis (karbonilas) – elektroneigiamas deguonis palieka anglies atomą dalinai teigiamu.
- Karbokationai (R+) – labai reaguojantys elektrofilai naudojami daugelyje organinių transformacijų.
- Nitroniukas (NO2+) – pagrindinis elektrofilas nitracijos reakcijose.
- Kataliziniai Lewis rūgščių kompleksai, pvz., AlCl3, BF3 – priima elektronų poras ir generuoja aktyvius elektrofilus (pvz., acilio jonus).
- Oksidatoriai, kurie priima elektronus – kai kurie iš jų veikia kaip elektrofilai cheminėse oksidacijos reakcijose.
Hard/Soft (HSAB) požiūris
Pagal HSAB teoriją elektrofilai skirstomi į „kietus“ ir „minkštus“. Kieti elektrofilai (pvz., H+, NO2+) linkę reaguoti su kietais nukleofilais (pvz., OH-, F-), o minkšti elektrofilai (pvz., R+, sudėtingesni metalų centrų kompleksai) – su minkštais nukleofilais (pvz., I-, S-dalykai). Šis principas padeda prognozuoti selektyvumą ir reakcijų greitį.
Kaip nustatyti elektrofilumą praktikoje?
- Reakcijos greitis su standartiniais nukleofilais ar palyginimas tarp modelinių reakcijų.
- Spektroskopiniai tyrimai (pvz., NMR) gali parodyti, kur kaupiasi teigiamas krūvis ir kaip lengvai susidaro tarpiniai jonai.
- Skaičiavimai (konceptualioji DFT) – elektromobiliškumo indeksas (electrophilicity index ω) naudojamas kiekybiškai įvertinti elektrofilumą.
Keli praktiniai pastebėjimai ir sauga
Stiprūs elektrofilai dažnai yra labai reaktyvūs, koroziniai arba toksiški (pvz., stiprios Lewis rūgštys, akceleratoriai). Laboratorijoje reikia naudoti tinkamas apsaugos priemones ir kontroliuoti temperatūrą bei tirpiklius, nes netinkamos sąlygos gali sukelti nepageidaujamas pusines reakcijas arba savavališką medžiagų apdegimą.
Trumpai tariant, elektrofilas – tai elektronų priėmėjas: jo savybės priklauso nuo struktūros, krūvio, aplinkinių grupių ir tirpiklio, o supratimas, kas daro tam tikrą centrinį atomą elektrofiliniu, yra esminis prognozuojant organinių ir neorganinių reakcijų eigą bei produktų selektyvumą.
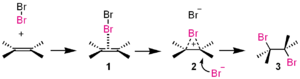
Šioje adicijos reakcijoje bromas (Br2 ) yra elektrofilas
Klausimai ir atsakymai
K: Kas yra elektrofilas?
A: Elektrofilas - tai molekulė arba atomas, kuris mielai priima elektronus iš kitos molekulės arba atomo.
K: Kodėl elektrofilai dar vadinami Lewiso rūgštimis?
A: Elektrofilai dar vadinami Lewiso rūgštimis, nes jie gali priimti elektronų poras iš kitų molekulių.
K: Kokie yra elektrofilų pavyzdžiai?
A: Kai kurie elektrofilų pavyzdžiai yra molekulės, kurių atomų elektroneigiamumas labai skiriasi, pavyzdžiui, HCl arba karbonilas, taip pat oksidatoriai.
K: Kaip nukleofilai reaguoja su elektrofilais?
A: Nukleofilai reaguoja su elektrofilais juos atakuodami.
K: Kas yra nukleofilas?
Atsakymas: Nukleofilas yra elektrofilui priešinga molekulė. Tai molekulė arba atomas, kuris mielai atiduoda elektronus.
K: Kaip vyksta adicijos reakcijos tarp elektrofilų ir nukleofilų?
A: Adityvinės reakcijos vyksta tarp elektrofilų ir nukleofilų, kai nukleofilas atakuoja elektrofilą, sudarydamas naują ryšį.
K: Ar elektrofilas gali turėti neigiamą krūvį?
A: Elektrofilas gali turėti teigiamą krūvį, tačiau jis taip pat gali turėti dalinį teigiamą krūvį arba visai neturėti krūvio. Pagrindinė savybė yra ta, kad jis nori priimti elektronus.
Ieškoti