PereinamojI būsena (cheminė): apibrėžimas, reikšmė ir savybės
Sužinokite, kas yra cheminė pereinamoji būsena: apibrėžimas, aktyvavimo energija, savybės, tyrimo metodai ir reikšmė reakcijų mechanikai.
Cheminės reakcijos metu pereinamoji būsena yra taškas reakcijos potencialo energijos paviršiuje, kuriame sistema turi didžiausią energiją palei reakcijos koordinatę. Ši energija, reikalinga reagentams pasiekti pereinamąją būseną, vadinama aktyvavimo energija. Kai dvi ar daugiau molekulių susiduria su pakankama energija, jos gali peržengti šią energijos sienelę ir pereiti į produktus. Pereinamojoje būsenoje vienu metu gali formuotis nauji ryšiai ir byrėti seni — tai yra sandūra, kurioje vyksta cheminis persitvarkymas. Grafike arba brėžinyje pereinamoji būsena dažnai žymima dvigubu ‡ simboliu ir atitinka pirmojo tipo balno tašką (saddle point) potencialo energijos paviršiuje.
Savybės
- Energetinis aukštumas: pereinamoji būsena yra lokaliai aukščiausias energijos taškas palei minimalų energetinį kelią tarp reagentų ir produktų.
- Vienas neigiamas dažnis: kvantiniame aprašyme pereinamoji būsena apibūdinama kaip pirmos eilės balno taškas — ji turi vieną „įsivaizduojamą“ (imaginarų) vibracinį dažnį, susijusį su reakcinės koordinatės judesiu.
- Trumpas gyvenimo laikas: ji egzistuoja labai trumpą laiką (dažniausiai femtosekundžių ar pikosekundžių skalėje), todėl jos tiesiogiai izoliuoti praktiškai neįmanoma.
- Nebūna minimume: skirtingai nuo tarpinių būsenų, pereinamųjų būsenų energija nėra lokaliai minimali — jos negali „išsilaikyti“ ilgiau ir nėra izoliuojamos kaip atskiros molekulės.
Skirtumas tarp pereinamosios būsenos ir tarpinės būsenos
Tarpinės būsenos randamos energijos minimume, gali būti santykinai stabilios ir, kai kuriais atvejais, izoliuojamos ar aptinkamos eksperimentais. Pereinamoji būsena yra trumpalaikė viršūnė energijos kelyje — ji yra „kirtimo“ taškas tarp reagentų ir produktų, o ne sustojimo vieta.
Kaip tyrinėjamos pereinamosios būsenos
- Teoriniai skaičiavimai: kompiuterinės metodikos (pvz., DFT, ab initio metodai) leidžia rasti pereinamųjų būsenų geometriją, apskaičiuoti jų energijas ir patikrinti, ar randama struktūra turi vieną imaginarią dažnį. Taip pat naudojama intrinsic reaction coordinate (IRC) analizė, siekiant parodyti, kad rastoji pereinamoji būsena jungia konkrečius reagentus ir produktus.
- Ultragreita spektroskopija: femtosekundinės lazerinės technikos leidžia tiesiogiai stebėti trumpalaikes būsenas ir kinetiką (femtochemija), nors dažniausiai gaunami netiesioginiai duomenys apie pereinamąją būseną.
- Tarpinių analogai ir stabilizavimas: cheminiai „trikdžiai“ arba katalizatoriai gali stabilizuoti tam tikrus pereinamosios būsenos elementus arba leisti stebėti reakcijos eigos žingsnius.
- Kinetiniai eksperimentai: reakcijos greičio priklausomybė nuo temperatūros (Arrhenius ar Eyring lygtis) leidžia išskaičiuoti aktyvacijos energiją ir laisvosios energijos barjerus, kas duoda informacijos apie pereinamąją būseną.
Reikšmė cheminių reakcijų mechanikose
Pereinamoji būsena lemia reakcijos greitį ir selektyvumą: kuo žemesnė energija pereinamojoje būsenoje (mažesnis energijos barjeras), tuo greičiau procesas vyksta. Cheminiai katalizatoriai dažnai būtent mažina pereinamosios būsenos energiją arba keičia reakcinį kelią, kad būtų pasiektas mažesnis energijos barjeras. Tai yra centrinis principas tiek pramoninėse, tiek biocheminėse katalizėse (pvz., fermentai stabilizuoja pereinamąją būseną).
Konceptualūs modeliai ir taisyklės
- Hammondo postulatas: teigia, kad pereinamoji būsena panaši į tą cheminę būseną (reagentą ar produktą), prie kurios ji artimesnė energiniu požiūriu — tai padeda numatyti pereinamosios būsenos struktūrinius bruožus reaguojant (eksoterminėse reakcijose TS panašesnė į reagentus, endoterminėse — į produktus).
- Transition State Theory (TST): teorija, susiejanti reakcijos greitį su pereinamosios būsenos entalpija ir entropija; iš jos gaunamos praktinės lygties (pvz., Eyring lygtis), kuri susieja greitį su aktyvacijos laisvąja energija.
Pavyzdžiai
- SN2 reakcija: tipiška vieno žingsnio reakcija, kurioje pereinamojoje būsenoje vienu metu jungiamas naujas ryšys ir skyla senasis — tai nukleofilinis backside ataka su Walden inversija.
- Periciklinės reakcijos: dažnai turi labai specifines pereinamąsias būsenas, kurių simetrija lemia, ar reakcija yra termiškai leistina.
- Fermentų aktyvumas: fermentai sumažina energijos barjerą, stabilizuodami pereinamąją būseną arba nukreipdami reakciją palankesniu keliu.
Pereinamųjų būsenų suvokimas ir modeliavimas yra esminė dalis norint išmanyti reakcijų mechanizmus ir projektuoti efektyvius katalizatorius ar sintezės metodus. Taip pat tai svarbi cheminės kinetikos sritis — žinodami pereinamosios būsenos energiją ir savybes, galime prognozuoti reakcijų greičius ir jų sąlygas.
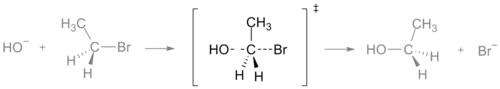
SN2 reakcijos pereinamoji būsena
Klausimai ir atsakymai
K: Kas yra cheminės reakcijos pereinamoji būsena?
A: Pereinamoji būsena yra taškas, kuriame cheminės reakcijos metu energija yra didžiausia.
K: Kas yra cheminės reakcijos aktyvavimo energija?
A: Energija, kurios reikia, kad reakcija įvyktų, vadinama aktyvacijos energija.
K: Kas atsitinka, kai cheminėje reakcijoje susimaišo dvi ar daugiau molekulių?
Atsakymas: Kai dvi ar daugiau molekulių susimaišo, jos atsitrenkia viena į kitą. Jei jos atsitrenkia su pakankama energija, kad pereitų pereinamąją būseną, jos reaguoja ir sudaro naujas molekules.
Klausimas: Ką reiškia dvigubas dagtis (‡) cheminės reakcijos grafike arba brėžinyje?
A: Dvigubas dagtis (‡) naudojamas pereinamajai būsenai pažymėti cheminės reakcijos grafike arba brėžinyje.
K: Kodėl sunku ištirti cheminės reakcijos pereinamąją būseną?
A: Cheminės reakcijos pereinamąją būseną tirti labai sunku, nes jos energija yra tokia didelė, kad molekulės išlieka tokios formos labai trumpą laiką, dažniausiai femtosekundes.
K: Kas yra cheminės reakcijos tarpinė grandis?
Atsakymas: Tarpinis junginys - tai molekulė, kuri cheminėje reakcijoje yra minimalios energijos taškuose ir gali gyvuoti labai ilgai.
K: Kodėl pereinamųjų būsenų tyrimas yra svarbus norint suprasti reakcijų mechanizmus?
A: Pereinamųjų būsenų tyrimas svarbus reakcijų mechanizmams suprasti, nes padeda nustatyti, kaip vyksta reakcija ir kaip ją valdyti arba manipuliuoti.
Ieškoti