Cheminės reakcijos mechanizmas — kas tai, etapai ir pagrindiniai tipai
Cheminės reakcijos mechanizmas: žingsnis po žingsnio etapai, tarpinės būsenos ir pagrindiniai tipai — nukleofilinis pakeitimas, eliminacija, adjunkcija. Sužinokite daugiau.
Reakcijos mechanizmas - tai žingsnis po žingsnio parašyta, kaip vyksta cheminė reakcija. Paprastai reakcijos metu matomas tik bendras pokytis. Tarpiniai dalykai reaguoja per greitai, kad juos būtų galima pastebėti. Jie vadinami tarpiniais junginiais, o pereinant iš vieno tarpinio junginio į kitą pereinama į pereinamąją būseną. Tačiau svarbu suprasti visus etapus, dėl kurių įvyksta bendras pokytis. Taip yra todėl, kad tada galima suprasti sudėtingesnes reakcijas arba bandyti priversti reakciją veikti tam tikru būdu.
Reakcijos mechanizmai gali būti įvairūs. Organinėje chemijoje dažniau pasitaikantys yra nukleofilinio pakeitimo, eliminacijos ir adjunkcijos. Žmonės kartais naudoja rodyklių stūmimą, norėdami nupiešti, kaip elektronai juda reakcijos metu. Taip lengviau matyti, kurios jungtys proceso metu susidaro, o kurios nutrūksta.
Kas sudaro mechanizmą — elementarūs etapai ir energijos barjerai
Mechanizmas susideda iš vienos ar kelių elementarių reakcijų stadijų. Kiekviena stadija turi savo pereinamąją būseną, o tarp stadijų gali atsirasti trumpalaikiai tarpiniai junginiai (pvz., radikalai, karbokationai, karboanionai). Energetiškai mechanizmas vaizduojamas reagento–produkto energijos diagramoje: reactantai → pereinamasis taškas (aukšta energija) → tarpinis (mažesnė energija) → kitas pereinamasis taškas → produktai. Viena iš svarbiausių sąvokų yra ribinis žingsnis arba rate-determining step — tai lėtiausia stadija, kuri lemia bendrą reakcijos greitį.
Pagrindiniai mechanizmų tipai organinėje chemijoje (trumpai)
- Nukleofilinis pakeitimas (pvz., SN1, SN2): SN2 yra vieno žingsnio (koncertinis) mechanizmas, kuriame nukleofilas atakuoja tuo pačiu metu, kai iškrenta paliekamoji grupė — dažnai matomas apverstas stereocentras. SN1 vyksta per karbokationo tarpį (dviejų etapų mechanizmas) ir jo greitis priklauso tik nuo substrato (unimolekulinis pradinis žingsnis).
- Eliminacija (pvz., E1, E2): E2 yra koncertinis pašalinimas, dažnai konkurentuoja su SN2; E1 vyksta per karbokationo tarpą analogiškai SN1.
- Adjunkcija / addicija: dvigubų jungčių prijungimas (pvz., elektrofiliška adicija prie alkenų), dažnai vyksta per protonavimo arba radikalinį tarpinį junginį.
- Radikaliniai grandininiai procesai: paleidimas, propagacija ir terminacija — būdingi polimerizacijai ir halogenacijai šviesoje.
Koncertiniai vs žingsniniai mechanizmai
Koncertiniame mechanizme visi reikšmingi elektronų pasikeitimai įvyksta vienu žingsniu per vieną pereinamąją būseną (pvz., SN2, E2). Žingsniniame mechanizme susidaro akivaizdūs tarpiniai junginiai ir kiekvienam žingsniui priklauso atskira pereinamąja būsena (pvz., SN1, E1). Šis skirtumas svarbus tiek mechanistikos supratimui, tiek reakcijos sąlygų optimizavimui.
Kaip nustatoma mechanizmo prigimtis
- Kineta (greičio dėsniai): eksperimentiniai greičio matavimai leidžia nustatyti, ar reakcija yra uni- ar bimolekulinė, ir ar yra tarpiniai žingsniai.
- Izotopų žymėjimas: pavyzdžiui, deuterio efektai gali atskleisti, ar įvyksta izomerizacija ar arina C–H ryšio skilimas greitinančiame žingsnyje.
- Spektroskopija ir trumpalaikės stebėsenos metodai: UV‑Vis, IR, NMR, masa spec. ar stop-flow metodai gali aptikti arba paremti tarpinį junginį.
- Kompiuterinės modelių skaičiavimai: DFT ir kiti kvantinės chemijos metodai padeda numatyti pereinamąsias būsenas, energijos barjerus ir tarpininkų stabilumą.
Praktiniai veiksniai, lemiantys mechanizmą
- Substrato struktūra (pirminis, antrinis, tretinis anglies centras), kuri lemia karbokationo stabilumą.
- Nukleofilų/elektrofilų stiprumas — stiprūs nukleofilai skatina SN2, silpnai nukleofilai gali eiti per SN1.
- Paliekamoji grupė — geresnė paliekamoji grupė palengvina heterolizę ir E1/SN1 tipus.
- Solventas — poliarūs protiniai tirpikliai stabilizuoja joninius tarpininkus (skatina SN1/E1), poliarūs aprotiniai tirpikliai skatina SN2.
- Temperatūra ir katalizatoriai — katalizatoriai mažina aktyvacijos energiją ir gali pakeisti mechanizmą arba padidinti selektyvumą.
Rodyklių stūmimas ir taisyklės
Organinėje mechanikoje dažnai naudojamos kreivosios rodyklės, kurios žymi elektronų porų judėjimą. Bendros taisyklės:
- Rodyklė prasideda nuo elektronų šaltinio (lone poros ar sigma ryšio) ir veda į elektrono priėmėją (elektrofilą arba vietą, kur formuojasi arba nutrūksta ryšys).
- Visada saugokite elementarią elektronų balansą — kiekviena elektronų pora turi kilmę ir taikinį.
- Kreivųjų rodyklių žymėjimas padeda prognozuoti formalines krūvų pasiskirstymą tarpinėse struktūrose.
Kodėl mechanizmai svarbūs praktikoje
Mechanizmų supratimas leidžia:
- optimizuoti reakcijos sąlygas (tirpiklis, temperatūra, koncentracijos),
- racionaliai rinktis katalizatorius ar reaktantus,
- prognozuoti šalutinius produktus ir stereocheminius rezultatus,
- kuriant naujas sintezės strategijas ar saugesnes reakcijas — valdyti reaktorių sąlygas ir sumažinti nepageidaujamų pirotoksinių tarpinių susidarymą.
Trumpas pavyzdys
SN2 mechanizme, pavyzdžiui, halogenido pakeitimo reakcijoje su stipriu nukleofilu, matome vieno žingsnio procesą: nukleofilas atakuoja iš priešingos pusės, susidaro pereinamasis taškas su penkiasnės koordinacijos ar „sukomponuota“ būsena, o paliekamoji grupė išeina — galutinis rezultatas dažnai yra stereochemijos inversija. Priešingai, SN1 reakcijoje substratas pirmiausia atskiria paliekamąją grupę, susidaro karbokationas (tarpinis), o tada nukleofilas prisijungia — čia gali vykti racemizacija, jei karbokationas yra stereocentras.
Išvados
Reakcijos mechanizmas yra ne tik teorinė sąvoka — tai praktinis įrankis chemikui. Suprasdami mechanizmus, galima numatyti reakcijos eigą, geriau kontroliuoti chemines transformacijas ir kurti efektyvesnes bei selektyvesnes sintezės strategijas. Eksperimentai kartu su spektroskopija ir skaičiavimais leidžia tikslinti mechanistines hipotezes ir atskleisti trumpalaikes tarpinės būsenas bei pereinamąsias struktūras.
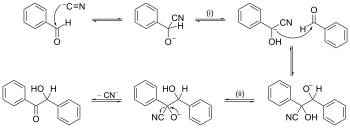
Reakcijos mechanizmo pavyzdys su rodyklės stūmimu
Klausimai ir atsakymai
K: Kas yra reakcijos mechanizmas?
Atsakymas: Reakcijos mechanizmas - tai žingsnis po žingsnio pateiktas cheminės reakcijos veikimo paaiškinimas.
K: Kodėl svarbu suprasti visus reakcijos mechanizmo etapus?
Atsakymas: Svarbu suprasti visus reakcijos mechanizmo žingsnius, kad suprastumėte sudėtingas reakcijas arba bandytumėte priversti reakciją veikti tam tikru būdu.
K: Kas yra tarpiniai cheminės reakcijos produktai?
Atsakymas: Tarpiniai produktai - tai dalykai, kurie susidaro tarp reakcijų, reaguojančių per greitai, kad juos būtų galima pastebėti cheminės reakcijos metu.
K: Kas yra pereinamoji būsena cheminėje reakcijoje?
A: Pereinamoji būsena pereinama pereinant iš vienos tarpinės medžiagos į kitą vykstant cheminei reakcijai.
K: Kokie yra dažniau pasitaikantys reakcijų mechanizmų tipai organinėje chemijoje?
Atsakymas: Organinėje chemijoje dažniau pasitaikantys reakcijų mechanizmai yra nukleofilinė substitucija, eliminacija ir adicija.
K: Kas cheminės reakcijos mechanizme yra rodyklės stūmimas?
Atsakymas: Kartais rodyklės stūmimas naudojamas norint nupiešti, kaip elektronai juda reakcijos metu. Taip lengviau matyti, kurios jungtys proceso metu susidaro ir kurios nutrūksta.
K: Kokios informacijos galima gauti supratus reakcijos mechanizmą?
A: Supratus reakcijos mechanizmą galima gauti informacijos apie tai, kaip priversti reakciją vykti taip, kaip norite, arba suprasti sudėtingesnes reakcijas.
Ieškoti