Sulfoksidai – struktūra, chiralumas, savybės ir DMSO panaudojimas
Sulfoksidai: struktūra, chiralumas, savybės ir DMSO pritaikymai — išsamus vadovas apie cheminę sandarą, reakcijas, ligandus ir biocheminį naudojimą.
Sulfoksidas — tai molekulė, kurioje sieros atomas susijungęs su dviem angliarūgštėmis (t. y. dviem anglies sruogomis) ir vienu deguonies atomu. Sulfoksidai dažniausiai susidaro oksiduojant tioetrus (thioeterus) — t. y. atliekant selektyvų sieros oksidavimą, bet ne iki galo, kai susidarytų sulfonas. Daugelis sulfoksidų turi ryškų, kartais aštrų kvapą.
Struktūra ir chiralumas
Sulfoksidai dažnai rašomi bendrąja formule R–S(=O)–R'. Siera turi dvigubą ryšį su deguonimi ir viengubą ryšį su dviem anglimi, o prie sieros taip pat yra vieniša pora elektronų. Elektroninė geometrija aplink sieros atomą yra artima tetraedrinei (trys ryšiai + viena vieniša pora), o molekulinė geometrija dažniau apibūdinama kaip trigubai piramidalinė (trigonal pyramidal), todėl sieros centras gali būti stereocentras.
Jeigu R ir R' yra skirtingi, siera gali būti chiralinis centras, taigi sulfoksidas gali egzistuoti kaip dvi enantiomerinės formos. Daugeliu atvejų šios konfigūracijos yra pakankamai stabilios kambario temperatūroje, todėl enantiomerai gali būti atskirti ir panaudoti asimetrinėse sintezėse ar kaip optiškai aktyvūs reagentai.
Fizikinės ir cheminės savybės
Sulfoksidai yra polinės, dažnai gerai tirpstančios medžiagos. Sieros–deguonies S=O grupė yra labai dipolinė, todėl sulfoksidai yra gera hidrogeno ryšio priimančioji terpė ir dažnai elgiasi kaip polarūs, aprotiniai tirpikliai (ypač mažesni sulfoksidai, pvz., dimetilsulfoksidas). Sulfoksidai taip pat geba koordinuoti pereinamųjų metalų centrus ir yra žinomi kaip geri pereinamųjų metalų ligandai, dažniausiai koordinuodamiesi per deguonies atomą.
Chemiškai sulfoksidai gali dalyvauti daugelyje reakcijų: oksidacijose iki sulfonų, redukcijose atgal iki tioeterų, taip pat įvairiuose perestervinimo ir rekombinaciniuose procesuose (pvz., Pummererio perstūmimai su specifiniais reagentais).
Gamyba ir oksidacija
Sulfoksidai paprastai gaunami selektyvia oksidacija iš tioeterų. Įprasti oksidantai yra perrūgštys (pvz., mCPBA), vandenilio peroksidas ar katalitinės sistemos, leidžiančios kontroliuoti oksidacijos laipsnį, kad nebūtų pereita iki sulfonų. Reakcijų sąlygos parenkamos taip, kad oksidacija būtų sulfoksido stadijoje — tai svarbu tiek organinėje sintezėje, tiek pramonėje.
Dimetilsulfoksidas (DMSO) — savybės ir panaudojimas
Svarbi sulfoksidų grupės atstovė yra dimetilsulfoksidas (DMSO). Šis junginys dažnai minima kaip (CH3)2S=O ir yra plačiai naudojamas kaip tirpiklis daugelyje reakcijų, ypač biochemijoje ir organinėje sintezėje. DMSO yra polinis, aprotinis tirpiklis, labai gerai tirpinantis tiek organines, tiek daugelį neorganinių medžiagų; jis yra mišus su vandeniu ir daugeliu organinių tirpiklių.
Praktinės DMSO savybės ir panaudojimai:
- Tirpiklis: plačiai naudojamas reakcijoms, kur reikia polinės, aprotinės terpės; gerai tirpdo druskas, poliarines molekules ir daug organinių junginių.
- Reagentas: DMSO naudojamas kaip reagentas Swern oksidacijoje (alkoholų → aldehidai/ketonai), taip pat dalyvauja kitose transformacijose.
- NMR: DMSO-d6 yra įprastas NMR tirpiklis, kai reikalingas polinis tirpiklis su mažu gaubos signalu.
- Kryokonservavimas ir biologija: naudojamas kaip cryoprotektantas ląstelių šaldymo terpėje; taip pat eksperimentiniuose biologiniuose tyrimuose kaip transportinis tirpiklis.
Reikėtų paminėti saugumo aspektus: DMSO lengvai prasiskverbia per odą ir gali pernešti ištirpintas medžiagas į organizmą, todėl dirbant su DMSO būtina dėvėti apsaugines pirštines ir vengti kontakto su oda. DMSO turi specifinį kvapą (dažnai apibūdinamą kaip „česnakinis“), o prasta valytis DMSO tirpikliai gali būti kontaminuoti ir toksiški.
Aplikacijos ir pavyzdžiai
Sulfoksidai plačiai naudojami tiek akademinėje, tiek pramoninėje chemijoje: kaip tirpikliai, kaip reaktyvūs tarpiniai produktai, kaip ligandai metalų kompleksuose ir kaip chiraliniai komponentai asimetrinėse sintezėse. DMSO — vienas iš dažniausiai naudojamų sulfoksidų dėl savo universalumo ir palankių fiziokeminių savybių.
Apibendrinant: sulfoksidai yra svarbi organinės chemijos ir pramonės grupė — jų unikali struktūra (S=O su vieniša pora) lemia įdomų stereocheminį elgesį ir plataus profilio panaudojimą, o dimetilsulfoksidas yra vienas iš naudingiausių ir plačiausiai taikomų tirpiklių bei reagentų.
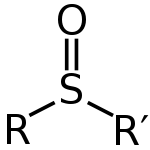
Bendroji sulfoksido struktūra
Klausimai ir atsakymai
Klausimas: Kas yra sulfoxidas?
Atsakymas: Sulfoksidas yra molekulė, kurioje sieros atomas yra susijungęs su dviem angliarūgštėmis ir vienu deguonies atomu.
K.: Iš kur atsiranda sulfoksidas?
A: Sulfoksidas susidaro oksiduojant tioetrus, bet ne iki galo pereinant į sulfoną.
K: Kokia yra bendroji sulfooksidų formulė?
A: Bendroji sulfooksidų formulė yra R-S(=O)-R'.
K: Kokios formos atomas yra sulfooksiduose?
A: Sulfoksidų atomo forma yra tetraedrinė.
K: Ar siera gali būti chiralinis centras sulfooksiduose?
Atsakymas: Taip, siera sulfoksiduose gali būti chiralinis centras.
K: Kas yra dimetilsulfoksidas ir kokia jo paskirtis?
A: Dimetilsulfoksidas, dar žinomas kaip DMSO, yra svarbi sulfoksidų molekulė, naudojama kaip tirpiklis daugelyje reakcijų, ypač biochemijoje.
K: Kodėl sulfooksidai naudojami kaip geri pereinamųjų metalų ligandai?
A: Sulfoksidai naudojami kaip geri pereinamųjų metalų ligandai, nes dėl elektronų poros ant sieros atomo jie geba koordinuotis su metalų jonais.
Ieškoti