Molekulinių virpesių apibrėžimas, tipai ir pavyzdžiai
Sužinokite molekulinių virpesių apibrėžimą, tipus ir aiškius pavyzdžius (H2, N2, O2) — suprantamai apie atomų judesį, vibracijas ir spektroskopinius principus.
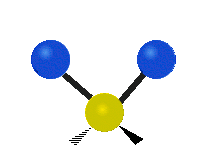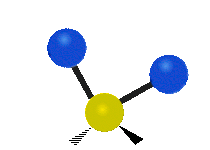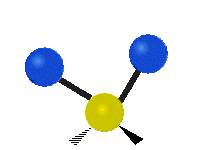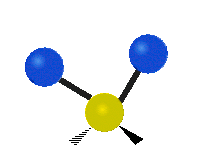
Molekuliniai virpesiai yra viena iš trijų skirtingų molekulių judėjimo rūšių: transliacinis judėjimas (kai visa molekulė juda ta pačia kryptimi) ir rotacinis judėjimas (kai molekulė sukasi kaip viršūnė). Vibracinis molekulės judėjimas yra tada, kai juda molekulės atomų tarpusavio ryšiai. Įsivaizduokite atomus kaip apvalius rutuliukus, kurie yra pritvirtinti spyruokle, galinčia išsitempti pirmyn ir atgal. Šio judesio pavyzdys yra tempimas — paprasčiausias molekulės virpesių pavyzdys, vykstantis tik tarp dviejų atomų. Keletas tokių molekulių pavyzdžių: vandenilis H2, azotas N2 ir deguonis O . 2
Kas tai yra ir kodėl svarbu
Molekuliniai virpesiai — tai atomų judesiai, keičiantys ryšių ilgį arba kampus tarp ryšių molekulėje. Jie yra kvantizuoti: molekulė gali turėti tik tam tikras energijos pakopas (vibracines būsenas), o net žemiausioje (pagrindinėje) būsenoje išlieka nulinės taško (zero-point) energija. Virpesiai yra svarbūs, nes:
- nusako cheminius ryšius (jėgą, standumą),
- leidžia analizuoti molekules naudojant infraraudonąją (IR) ir Raman spektroskopiją,
- dalyvauja cheminėse reakcijose ir energijos pernešime (pvz., neadiabatiniai procesai).
Virpesių tipai
Paprastai virpesius skirstome į kelias pagrindines kategorijas:
- Tempimo (stretching) — keičiasi atstumas tarp dviejų susijungusių atomų. Gali būti symetrinis (symmetric) arba asimetrinis (asymmetric) tempimas.
- Lenkimo (bending) — keičiasi kampas tarp ryšių; apima scissoring (žirklinis lankstymas), rocking, wagging ir twisting tipus.
- Vidiniai kampų virpesiai — susiję su kampų mažinimu/ar didinimu tarp trijų ar daugiau atomų grandinės.
Normaliosios modės ir jų skaičius
Kiekviena molekulė turi tam tikrą skaičių nepriklausomų vibracinių (normalinių) modų, priklausomai nuo atomų skaičiaus N:
- Linijinė molekulė: 3N − 5 nepriklausomų vibracinių modų.
- Nelinijinė molekulė: 3N − 6 nepriklausomų vibracinių modų.
Vienatomėms įprastai virpesių nėra, diatomėms (pvz., H2, N2) yra tik viena tempimo moda, o poliatominiuose junginiuose modų skaičius greitai auga.
Fizikinis aprašymas ir dažnis
Virpesius dažnai modeliuojame kaip harmoninį svyravimą (spyruoklė + masė). Pagrindinė formulė dviejų atomų sistema:
ν = (1/2π) · sqrt(k/μ) — dažnis (s−1),
čia k yra ryšio jėgos konstanta (force constant), o μ — sumažinta masė, apskaičiuojama kaip μ = m1·m2 / (m1 + m2). Dažnai spektruose naudojamas bangos skaičius (wavenumber) ˜ν (cm−1):
˜ν = (1/2πc) · sqrt(k/μ), kur c — šviesos greitis.
Harmoninis modelis suteikia aiškų pradinį supratimą, bet realiose molekulėse yra anharmoniškumas, dėl kurio atsiranda overtonai (dugninės linijos) ir kombinacinės juostos, o energijų skirtumai šiek tiek skiriasi nuo harmoninio atvejo.
Veiksniai, lemiantys virpesių dažnį
- Ryšio jėga (k) — stipresnis ryšys (didesnė k) → didesnis vibracijos dažnis.
- Atomų masės (μ) — didesnė sumažinta masė → žemesnis dažnis. Todėl H–X ryšiai turi didesnius dažnius nei sunkesnių atomų ryšiai.
- Ryšio tipas — viengubas, dvigubas, trigubas ryšiai turi skirtingas jėgos konstantas (pvz., C≡C vibracijos dažnis aukštesnis nei C–C).
Spektroskopinis atpažinimas: IR ir Raman
Virpesių aptikimui naudojamos dažniausiai dvi metodikos:
- IR spektroskopija — virpesis yra IR aktyvus, jei per vibraciją keičiasi molekulės dipolio momentas. Daug polinių ryšių (pvz., O–H, C=O) turi stiprias IR juostas.
- Raman spektroskopija — virpesis yra Raman aktyvus, jei per vibraciją keičiasi molekulės polarizuotumas (polarizability). Nepolarūs ryšiai ir simetrinės modos dažnai yra ryškesnės Ramano spektre.
Dažnai tam tikra moda gali būti aktyvi tiek IR, tiek Raman spektruose, o kartais — tik viename iš jų; tai naudojama molekulių analizėje ir struktūrų nustatyme.
Pavyzdžiai
- Diatominės molekulės: vandenilis H2, azotas N2, deguonis O . 2 — turi vieną tempimo virpesių modą (vibraciją).
- CO2 — turi tris vibracines modas: simetrinis tempimas (IR neaktyvus), asimetrinis tempimas (~2349 cm−1, IR aktyvus) ir lenkimo modas (~667 cm−1, dvigubai degenruotas).
- H2O — turi tris modas: du tempimo (~3650–3750 cm−1) ir vieną lenkimo (~1595 cm−1).
- Organinės grupės: C–H tempimai (~2800–3000 cm−1), C=O tempimai (~1650–1750 cm−1), N–H tempimai (~3300 cm−1) — dažnai naudojami organinių junginių identifikacijai.
Praktiniai pastebėjimai
- Spektrų interpretavimas leidžia nustatyti ryšių tipus, funkcines grupes ir molekulinę geometriją.
- Temperatūra, aplinkos terpė (pvz., skystis, dujos, kristalas) ir cheminė sąveika (vandeniliniai ryšiai) gali keisti vibracijos dažnį ir juostų pločius.
- Modernios metodikos (FTIR, dispersinė Raman spektroskopija) suteikia aukštą jautrumą ir rezoliuciją, leidžiančią fiksuoti net silpnai aktyvias modas.
Apibendrinant, molekuliniai virpesiai yra fundamentalus molekulių elgesio aspektas, kuris susieja cheminę struktūrą su spektroskopinėmis savybėmis ir energetika. Supratimas apie virpesių tipus, jų skaičių bei fizinius parametrus leidžia interpretuoti eksperimentinius duomenis ir modeliuoti molekulinius procesus.
Virpesių tipai
Jei molekulėje yra daugiau nei du atomai, viskas tampa sudėtingiau. Tarkime, kad pridedamas dar vienas atomas, todėl dabar yra trys atomai, kaip vandenyje H2 O, kur abu vandenilio atomai yra prijungti prie centrinio deguonies atomo. Prisiminkite, kad su vandeniliu buvo vienos rūšies tempimas, o vandenyje yra dviejų rūšių tempimas ir dar keturių rūšių virpesiai, vadinami lenkiamaisiais virpesiais, kaip parodyta toliau.
CH2 grupės atomai arba tokios molekulės kaip vanduo gali vibruoti šešiais skirtingais būdais: simetriškai ir antisimetriškai tampant, žirklėmis, siūbuojant, siūbuojant, siūbuojant ir sukant:
| Simetriškas tempimas | Antisimetrinis tempimas | Žirklės |
|
|
|
|
| Rocking | Raguojantis | Sukimas |
|
|
|
|
simetrinis tempimas: kai du prijungti atomai tuo pačiu metu juda nuo centrinio atomo ir link jo.
antisimetrinis tempimas: kai du prijungti atomai tuo pačiu metu nejuda nuo centrinio atomo ir link jo.
žirklės: Kaip ir sako pavadinimas, žirklės yra tada, kai du atomai tolsta vienas nuo kito ir artėja vienas prie kito.
svyravimai: Šis judesys panašus į laikrodžio švytuoklės judėjimą pirmyn ir atgal, tik čia švytuoklė yra atomas, o švytuoklių yra ne viena, o dvi.
vikriai: Jei žmogus laiko ranką priešais save ir du pirštus sudeda į "V" raidės ženklą, o riešą lenkia į save ir nuo savęs. Šiuo atveju pirštų galai yra pritvirtinti atomai, o riešas - centrinis atomas.
sukimas: Šis judesys primena žmogaus ėjimą ant bėgimo takelio, kur liemuo yra centrinis atomas, o kojos - du pritvirtinti atomai.
Molekulės, turinčios daugiau nei tris atomus
Molekulės, turinčios daugiau nei tris atomus, yra dar sudėtingesnės ir turi dar daugiau virpesių, kurie kartais vadinami "virpesių režimais". Kiekvienas naujas virpesių režimas iš esmės yra skirtingas pirmiau pateiktų šešių virpesių derinys. Kuo daugiau atomų molekulėje, tuo daugiau būdų, kaip jie gali būti derinami. Daugumos molekulių, turinčių N atomų, galimų tos molekulės virpesių skaičius yra 3N - 6, o linijinės molekulės, arba molekulės, kuriose atomai išsidėstę tiesia linija, turi 3N-5 virpesių režimus.
Energijos ir vibracijos ryšys
Niutono mechanika
Remiantis Niutono mechanika, molekulės virpesius galima apskaičiuoti traktuojant ryšius kaip spyruokles. Tai naudinga, nes, kaip ir spyruoklei, ryšiui ištempti reikia energijos, o jam suspausti taip pat reikia energijos. Energija, kurios reikia ryšiui ištempti arba suspausti, priklauso nuo ryšio standumo, kurį nusako spyruoklės konstanta k, ir dviejų prie abiejų galų prijungtų atomų redukuotos masės arba "masės centro", žymimo μ. Energijai, reikalingai ryšio virpesiui sukelti, susieti naudojama formulė:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \over {2\pi }}{\sqrt {k \over \mu }}.\! }
h: yra Planko konstanta
ν - dažnis, rodantis, kaip greitai ryšys susiglaudžia ir vėl išsiskiria. Kuo didesnis ν, tuo greitesnis šis greitis.
Ε: tai energija, kurios reikia ryšiui stumti ir traukti.
μ: Sumažinimo masė - tai dviejų atomų masės, padaugintos iš dviejų ir padalytos iš jų sudėties:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \per m_{1}+m_{2}}.\! }
Kvantinė mechanika
Naudojant kvantinę mechaniką, spyruoklę apibūdinanti formulė yra lygiai tokia pati, kaip ir Niutono mechanikos versija, išskyrus tai, kad leidžiama naudoti tik tam tikras energijas arba energijos lygmenis. Energijos lygius įsivaizduokite kaip laiptelius ant kopėčių, ant kurių žmogus vienu metu gali pakilti arba nusileisti tik vienu laipteliu. Lygiai taip pat, kaip tas žmogus negali stovėti ant erdvės tarp pakopų, taip ir ryšys negali turėti energijos tarp energijos lygmenų. Ši nauja formulė tampa:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1\over 2}\right){1\over {2\pi }}{\sqrt {k \over m}}}\! } 
kur n yra kvantinis skaičius arba "energijos lygis", kuris gali būti 0, 1, 2 ... Teiginys, kad energijos lygmenys vienu metu gali pakilti arba nusileisti tik į vieną lygmenį, vadinamas atrankos taisykle, kuri teigia, kad vieninteliai leistini perėjimai tarp energijos lygmenų yra šie:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
kur \Delta n yra energijos perėjimas.
Vibracinių judesių taikymas
Kai tam tikro dažnio šviesa patenka į molekulę, kurios vibracija atitinka tą patį dažnį, šviesa absorbuojama molekulėje, o šviesos energija priverčia ryšius judėti tam tikru vibraciniu judesiu. Tikrindami sugertą šviesą, mokslininkai gali nustatyti, ar yra tam tikros rūšies molekulinis ryšys, ir palyginti jį su molekulių, turinčių tokį ryšį, sąrašu.
Tačiau kai kurios molekulės, pavyzdžiui, helio ir argono, turi tik vieną atomą ir neturi jokių ryšių. Tai reiškia, kad jos neabsorbuoja šviesos taip, kaip tai gali padaryti molekulė, turinti daugiau nei vieną atomą.
Konkrečios chemijos sritys, kuriose atliekant tyrimus naudojami molekuliniai virpesiai, yra infraraudonųjų spindulių spektroskopija (IR) ir Ramano spektroskopija (Raman), iš kurių IR naudojama plačiau ir turi tris atskiras pakraipas. Šios pakraipos vadinamos artimosios IR, viduriniosios IR ir tolimosios IR spektroskopija. Toliau pateikiamas bendras šių sričių ir realaus pasaulio taikymo sričių sąrašas
Artimoji IR: kiekybinis rūšių, tokių kaip baltymai, riebalai, mažos molekulinės masės angliavandeniliai ir vanduo, nustatymas. Toliau naudojamas žemės ūkio produktų, maisto, naftos ir chemijos pramonėje.
Vidutinė IR: populiariausia iš IR sričių, naudojama organinių ir biocheminių junginių struktūrai nustatyti.
Tolimoji IR spinduliuotė: ši sritis mažiau populiari, nors ji naudojama neorganiniuose tyrimuose.
Ramanas: Ramano spinduliuotė: naudojama neorganinių, organinių ir biologinių sistemų kokybiniams ir kiekybiniams tyrimams, dažnai kaip papildomas metodas prie IR.
Ieškoti