pH — kas tai? Rūgštingumo skalė, formulė ir H+ jonų aktyvumas
Sužinokite, kas yra pH: rūgštingumo skalė, pH formulė, H+ jonų koncentracija ir aktyvumas. Aiškus paaiškinimas nuo 0 iki 14 ir už jos ribų.
pH yra skaitmeninė skalė nuo 0 iki 14, rodanti, kiek tirpalas yra rūgštus arba šarminis. Kuo tirpalas rūgštesnis, tuo mažesnis jo pH; kuo jis šarminesnis, tuo pH didesnis. Neutralūs tirpalai (nei rūgštūs, nei šarminiai) dažniausiai turi pH ≈ 7. Rūgščių pH yra mažesnis nei 7, o šarmų — didesnis nei 7.
Ką reiškia pH?
pH — tai protonų (H+) koncentracijos arba aktyvumo tirpale matas. Sąvoką 1909 m. įvedė S. P. L. Sørensenas. Raidė P kilusi iš vokiško žodžio potenz, reiškiančio „galia“ arba „laipsnis“, o H reiškia vandenilio joną (H+).
Formulės ir matematinis apibrėžimas
Dažniausiai naudojama pH apskaičiavimo formulė yra:
pH = - log 10 [ H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}
Čia [H+] reiškia H+ jonų koncentraciją (kartais rašoma ir kaip [H3O+], tai yra vienoda vandenilio jonų koncentracija), matuojamą molais litre (molingumu, mol/L).
Tačiau griežtesnis apibrėžimas naudoja jonų aktyvumą:
pH = - log 10 [ a H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}}} }\right]}
Kur a H + {\displaystyle a_{\mathrm {H^{+}} }}
pH skalė ir jos ribos
Daugumos medžiagų pH paprastai svyruoja tarp 0 ir 14, jei matuojama įprastomis sąlygomis (vandens tirpaluose esant ~25 °C). Tačiau itin stiprių rūgščių ar šarmų tirpalų pH gali būti mažesnis nei 0 arba didesnis nei 14 — tai reiškia, kad pH skalė nėra griežtai ribota 0–14.
Šarminėse medžiagose vietoj laisvų vandenilio jonų dominuoja hidroksido jonai (OH-); pH ir OH- koncentracija susiję per vandens autoprotolizės konstantą (Kw).
Keli praktiniai pavyzdžiai
- 0,01 M HCl → [H+] = 1·10^-2 mol/L → pH = 2.
- 0,001 M HCl → pH = 3.
- 0,1 M NaOH → [OH-] = 0,1 mol/L → pOH = 1 → pH ≈ 13 (priklauso nuo temperatūros).
- Grynas vanduo (25 °C) turi [H+] = 1·10^-7 mol/L → pH = 7.
Matuojant pH
Paprastai pH matuojama dviem pagrindiniais būdais:
- Elektroniniu pH metru (stiklinė elektrodė, kalibracija su buferiniais tirpalais) — tiksliausias metodas laboratorijose ir pramonėje.
- Indikatorinėmis priemonėmis: lakmuso popierėlis, universalios indikatoriaus juostelės arba cheminės indikatorinės medžiagos (pvz., fenolftaleinas) — greitam apytikriam nustatymui.
Teisingas matavimas reikalauja elektrodų kalibracijos, tinkamo mėginio paruošimo (temperatūros stabilizavimo, filtravimo) ir žinojimo apie joninės jėgos poveikį.
pH reikšmė biologijoje ir pramonėje
pH turi didelę reikšmę daugelio procesų eigai:
- Žmogaus kraujo pH labai griežtai reguliuojamas — apie 7,35–7,45; dideli nukrypimai gali būti gyvybei pavojingi.
- Enzimų aktyvumas priklauso nuo pH; kiekvienam fermentui būdingas optimalus pH intervalas.
- Žemės ūkis: dirvožemio pH lemia maistinių medžiagų prieinamumą augalams.
- Pramonėje: cheminės reakcijos, korozija, vandens valymas ir maisto gamyba dažnai remiasi pH kontrole.
Buferiai ir pH stabilizavimas
Buferiniai tirpalai sudaryti iš silpnos rūgšties ir jos konjuguoto šarmo (arba atvirkščiai) ir saugo pH nuo didelių pokyčių prisidedant prie protono arba hidroksilo jonų perteklių. Buferiai yra būtini biologinėms sistemoms (pvz., kraujo buferinė sistema) ir įvairioms laboratorinėms procedūroms.
Temperatūros poveikis ir pOH
Vandens autoprotolizės konstanta Kw priklauso nuo temperatūros, todėl ir santykinė pH bei pOH reikšmė keičiasi su temperatūra. Esant 25 °C, pKw ≈ 14, todėl paprastai galioja ryšys pH + pOH = 14. Esant kitai temperatūrai, šis skaičius skirsis.
Saugumas
Labai žemas arba labai aukštas pH reiškia korozinę, odą ar audinius pažeidžiančią terpę. Su tokiais tirpalais reikia elgtis atsargiai: naudoti apsaugines priemones (akiniai, pirštinės) ir žinoti neutralizacijos bei šalinimo būdus.
Apibendrinant: pH yra pagrindinė vandens tirpalų savybė, kuri apibūdina H+ jonų koncentraciją arba aktyvumą. Tinkamas pH matavimas ir valdymas yra svarbus tiek mokslui, tiek praktikai, pradedant biologija ir baigiant pramone.
pH indikatoriai
Tam tikri dažai keičia spalvą priklausomai nuo to, ar jie yra rūgštiniame, ar šarminiame tirpale. pH indikatorius - tai cheminis junginys, nedideliais kiekiais dedamas į tirpalą, kad būtų galima nustatyti tirpalo pH (rūgštingumą arba šarmingumą). pH indikatorius yra cheminis vandenilio jonų (H3O+) arba vandenilio jonų (H+) detektorius. Įprastai dėl indikatoriaus tirpalo spalva keičiasi priklausomai nuo pH.
Tipiški indikatoriai yra fenolftaleinas, metilo oranžinis, metilo raudonasis, bromtimolio mėlynasis ir timolio mėlynasis. Kiekvienas iš jų keičia spalvą skirtinguose pH skalės taškuose ir gali būti naudojamas kartu kaip universalus indikatorius.
Kitas būdas - naudoti lakmuso popierėlį, kurio pagrindą sudaro natūralūs pH indikatoriai. Iš popieriaus galima sužinoti, kokio stiprumo yra cheminė medžiaga - ar tai stipresnė rūgštis, ar stipresnė bazė.
Kai kurios įprastos pH vertės
| pH | |
| Akumuliatoriaus rūgštis | 0 |
| Skrandžio rūgštis | 1.0 |
| Citrinų sultys | 2.4 |
| Cola | 2.5 |
| Deguonies prisotintas vanduo | 2.5 - 3.0 |
| Actas | 3.0 |
| Apelsinų arba obuolių sultys | 3.0 |
| Alus | 4.5 |
| Kava | 5.0 |
| Pienas | 6.6 |
| 7.0 | |
| Kraujas | 7.35 - 7.45 |
| Paprastas šampūnas | 8.0 |
| Jūros vanduo | 8.0 |
| Nuolatinė banga | 8.5 - 9.2 |
| Rankų muilas | 9.0 - 10.0 |
| Plaukų dažai | 9.5 - 10.5 |
| Magiška tiesi linija | 11.5 |
| Buitinis amoniakas | 11.5 |
| Baliklis | 12.3 |
| Kaustinė soda | 12.7 |
| Namų ūkio šarmai | 13.5 |
| Drenažo valiklis | 14 |
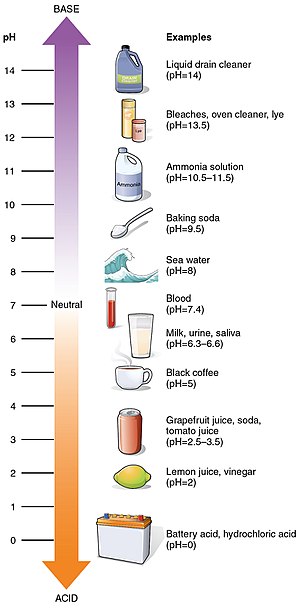
Kai kurių įprastų medžiagų pH vertės
Neutralizacija
Neutralizaciją galima apibendrinti lygtimi:
H+
+ OH-
→ H
2O
Susiję puslapiai
Klausimai ir atsakymai
K: Kas yra pH?
A: pH - tai rūgštingumo skalė nuo 0 iki 14, pagal kurią matuojama protonų (H+) koncentracija tirpale. Ji parodo, kiek medžiaga yra rūgštinė ar šarminė: rūgštesnių tirpalų pH yra mažesnis, o šarmingesnių - didesnis. Neutralių tirpalų pH paprastai būna 7.
K: Kas įvedė pH sąvoką?
A: S. P. L. Sørensenas šią sąvoką įvedė 1909 m.
K: Ką reiškia raidė "p" žodyje "pH"?
A: "p" reiškia vokišką žodį potenz, reiškiantį galią arba koncentraciją.
K: Kaip apskaičiuojamas pH?
Atsakymas: Dažniausiai naudojama formulė pH apskaičiuoti - tai neigiamas logaritmas iš 10 kartų H+ jonų (taip pat rašoma [H3O+], kas reiškia vienodą vandenilio jonų koncentraciją) koncentracijos, išmatuotos molais litre (arba molaringumu). Tačiau taip pat yra lygtis, kurioje atsižvelgiama ne tik į koncentraciją, bet ir į aktyvumą, todėl, priklausomai nuo situacijos, gali būti gaunamos kitokios vertės nei įprastesnėje formulėje.
Klausimas: Kokios yra daugumos medžiagų pH skalės ribos?
A: Daugumos medžiagų pH yra nuo 0 iki 14, nors itin rūgščių arba šarminių medžiagų pH gali būti ir už šio intervalo ribų (mažiau nei 0 arba daugiau nei 14).
K: Kuo pH skalėje šarminės medžiagos skiriasi nuo rūgštinių? Atsakymas: Šarminių medžiagų pH skalės reikšmės yra didesnės, nes jose yra hidroksido jonų (OH-), o ne vandenilio jonų, kaip rūgštyse.
Ieškoti
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)