Rūgštis – kas tai? Apibrėžimas, pH, stiprios ir silpnos rūgštys
Sužinokite, kas yra rūgštis: apibrėžimas, pH reikšmės, skirtumai tarp stiprių ir silpnų rūgščių, pavyzdžiai ir cheminė elgsena aiškiai ir suprantamai.
Straipsnis apie tam tikras duomenų bazių savybes yra ACID
Kartais rūgštis yra kitas narkotiko LSD (lizergo rūgšties dietilamido) pavadinimas.
Rūgštis - tai medžiaga, kuri gali perduoti vandenilio joną (H+ ) (paprastai tai būna protonas) kitai medžiagai. Rūgščių pH yra mažesnis nei 7,0. Cheminė medžiaga gali atiduoti protoną, jei vandenilio atomas yra prijungtas prie elektroneigiamo atomo, pavyzdžiui, deguonies, azoto ar chloro. Kai kurios rūgštys yra stiprios, o kitos - silpnos. Silpnosios rūgštys išlaiko kai kuriuos savo protonus, o stipriosios rūgštys atiduoda visus. Visos rūgštys į tirpalus išskiria vandenilio jonus. Pagal tai, kiek jonų išsiskiria vienoje molekulėje, sprendžiama, ar rūgštis yra silpna, ar stipri. Silpnosios rūgštys - tai rūgštys, kurios iš dalies išlaisvina prisijungusius vandenilio atomus. Taigi šios rūgštys gali sumažinti pH disocijuodamos vandenilio jonus, bet ne visiškai. Silpnųjų rūgščių pH paprastai būna 4-6, o stipriųjų rūgščių - 1-3.
Bazė yra rūgšties "cheminė priešingybė". Bazė yra medžiaga, kuri priima rūgšties vandenilio atomą. Bazės - tai molekulės, kurios gali skilti vandenyje ir išskirti hidroksido jonus.
Kas yra rūgštis – aiškiau ir platesnis paaiškinimas
Rūgštis cheminėje prasme dažniausiai apibrėžiama keliais papildomais principais:
- Arrhenius apibrėžimas: rūgštis vandeniniame tirpale didina vandenilio jonų (H+) koncentraciją, o bazė padidina hidroksido jonų (OH−) koncentraciją.
- Brønsted–Lowry apibrėžimas: rūgštis yra protono donorė (atiduoda H+), o bazė – protono akceptorė (priima H+).
- Lewiso apibrėžimas: rūgštis yra elektronų poros akceptorius, o bazė – elektronų poros donorė. Šis požiūris leidžia aprašyti reakcijas, kuriose neatliekamas aiškus protono pernešimas.
pH skalė ir ką ji reiškia
pH yra logaritminis rodiklis, matuojantis vandenilio jonų koncentraciją tirpale: kuo mažesnis pH, tuo daugiau H+. Standartinė pH skalė laboratorinėse sąlygose dažnai svyruoja nuo 0 iki 14 (nepaisant to, kad esant labai didelėms koncentracijoms galima gauti ir mažesnes arba didesnes reikšmes). Neutralus vanduo 25 °C temperatūroje turi pH ≈ 7. Rūgštiniai tirpalai turi pH < 7, o baziniai – pH > 7.
Reikia pabrėžti skirtumą tarp rūgšties stiprumo ir rūgšties koncentracijos: stiprumas nusako, kiek procentaliai molekulių disocijuoja (atiduoda protoną) vandenyje; koncentracija – kiek molekulių yra tirpale. Todėl stipri, bet labai praskiesta rūgštis gali turėti aukštesnį pH nei silpna, bet daug koncentruotesnė rūgštis.
Stiprios ir silpnos rūgštys
Stiprios rūgštys beveik visiškai disocijuoja vandenyje. Tipiški pavyzdžiai: sūrymo rūgštis HCl, azoto rūgštis HNO3, sieros rūgštis H2SO4 (pirmas protas labai stiprus). Stiprių rūgščių tirpalai paprastai turi labai mažą pH (dažnai 0–3, priklausomai nuo koncentracijos).
Silpnos rūgštys disocijuoja tik iš dalies. Dažni pavyzdžiai: acto rūgštis CH3COOH, anglies rūgštis H2CO3, fluoro rūgštis HF, fosforo rūgštis H3PO4. Silpnųjų rūgščių tirpalų pH priklauso ir nuo koncentracijos, ir nuo disociacijos laipsnio; dažnai vartojamas orientyras yra pH 4–6, bet tai nėra griežtas taisyklė.
Rūgščių stiprumas aprašomas disociacijos konstanta Ka arba jos logaritmu pKa. Kuo didesnis Ka (arba kuo mažesnis pKa), tuo rūgštis stipresnė.
Poliprotrinės rūgštys ir junginiai
Yra rūgščių, kurios gali atiduoti daugiau nei vieną protoną – tai poliprotrinės rūgštys, pvz., H2SO4 (dviprotė), H3PO4 (triprotė). Kiekvienam protui būna skirtingas disociacijos laipsnis ir skirtingas Ka (ir pKa).
Neutralizacija ir cheminės reakcijos
Rūgščių ir bazių reakcija – neutralizacija – generuoja vandenį ir druskas:
rūgštis + bazė → druska + H2O
Neutralizacijos metu keičiasi pH, todėl titravimo metodai leidžia nustatyti rūgšties koncentraciją praktiškai (naudojant indikatorių, pH metrą ar kitus būdus).
Indikatoriai ir matavimo būdai
- pH matuojama pH metru arba pH indikatorinėmis juostelėmis.
- Cheminė titracija su indikatoriumi (pvz., fenolftaleinu, metiloranžu) leidžia tiksliai nustatyti rūgšties arba bazės kiekį.
Saugumas ir praktinis panaudojimas
Rūgštys plačiai naudojamos pramonėje, laboratorijose ir kasdienybėje: valymui, metalų apdorojimui, trąšų gamybai, maisto pramonėje (acto rūgštis) ir kt. Tačiau daug rūgščių yra korozinės ir pavojingos: dirgina odą, akis, kvėpavimo takus ir gali sukelti sunkius nudegimus. Darbe su rūgštimis rekomenduojama naudoti apsauginius akinius, pirštines, ventiliaciją ir žinoti atitinkamus saugos duomenų lapus (MSDS).
Konjuguoti jonai ir amfoterija
Kiekviena rūgštis turi savo konjuguotą bazę – tai liekana, kuri lieka po protono atidavimo. Pvz., acto rūgštis CH3COOH konjuguota bazė yra CH3COO−. Kai kurios medžiagos yra amfoterinės – jos gali elgtis tiek kaip rūgštis, tiek kaip bazė (pvz., vanduo H2O).
Santrauka
- Rūgštis – protono donorė (Brønsted–Lowry) arba medžiaga, didinanti H+ koncentraciją tirpale (Arrhenius).
- Stiprumas priklauso nuo disociacijos laipsnio (Ka, pKa), o ne tik nuo cheminės formulės ar to, kiek protonų molekulė gali prarasti.
- pH rodo tirpalo rūgštinumą: mažesnis pH = daugiau H+.
- Rūgštys turi įvairias pritaikymo sritis, bet jas reikia saugiai naudoti dėl korozinių savybių.

Druskos rūgštis (stiklinėje) reaguoja su amoniako garais ir susidaro amonio chloridas (balti dūmai).
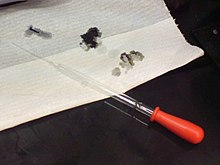
Rūgštys gali būti pavojingos: Skylės popieriuje padarytos 98% sieros rūgšties tirpalu.
Kaip veikia rūgštys
Rūgštys ir bazės paprastai egzistuoja kartu pusiausvyros sąlygomis. Tai reiškia, kad viename rūgšties mėginyje kai kurios molekulės atiduoda savo protonus, o kitos juos priima. Net vanduo yra rūgštinio jono H3 O+ (vadinamo hidronio jonu) ir bazinio jono OH- (vadinamo hidroksido jonu) mišinys. Hidronio jonas atiduos savo protoną hidroksido jonui, sudarydamas dvi neutralaus H O molekules. 2Ši reakcija vandens mėginyje vyksta nuolat, tačiau apskritai mėginys yra neutralus, nes jame yra vienodas kiekis hidronio ir hidroksido. Tačiau daugumoje reakcijų rūgščių ir bazių yra ne vienodi kiekiai, ir būtent dėl šio disbalanso gali vykti cheminė reakcija.
Kiekviena rūgštis turi konjuguotą bazę, kuri susidaro pašalinus rūgšties protoną. Pavyzdžiui, druskos rūgštis (HCl) yra rūgštis, o jos konjuguota bazė yra chloro anijonas arba Cl-. Rūgšties ir jos konjuguotos bazės stiprumas yra priešingas. Kadangi HCl yra stipri rūgštis, Cl -yra silpna bazė.
Savybės
Rūgštys gali būti skirtingo stiprumo, kai kurios jų yra reaktyvesnės už kitas. Reaktyvesnės rūgštys dažnai yra pavojingesnės.
Rūgštys, priklausomai nuo jų molekulinės struktūros, gali turėti daug skirtingų savybių. Dauguma rūgščių pasižymi šiomis savybėmis:
- valgomi rūgštaus skonio.
- palietus gali įgelti į odą.
- gali suardyti (arba suėsti) metalus ir odą.
- gali būti naudojamas kaip reagentas elektrolizės metu dėl judriųjų jonų buvimo
- mėlyną lakmuso popierėlį paversti raudonu.
- universalaus indikatoriaus spalva tampa raudona arba oranžinė.
- praleidžia elektrą
Rūgštys gali nudeginti odą, o nudegimo stiprumas priklauso nuo rūgšties rūšies ir koncentracijos. Dėl šių cheminių nudegimų būtina nedelsiant kreiptis į gydytoją.
Kadangi rūgštys atiduoda vandenilio jonus, visose rūgštyse turi būti vandenilio.

Įspėjamasis paveikslėlis, naudojamas su pavojingomis rūgštimis ir šarmais. Bazės yra rūgščių priešingybės.
Svarbumas
Rūgštys yra svarbios. Nukleino rūgštys, pavyzdžiui, DNR ir RNR, yra genetinis kodas. Šios molekulės lemia daugelį organizmo savybių, jos perduodamos iš tėvų palikuonims. DNR yra planai, kaip sukurti baltymus, kurie sudaryti iš aminorūgščių.
Riebalų rūgštys ir jų dariniai yra dar viena karboksirūgščių grupė, kuri atlieka svarbų vaidmenį biologijoje. Jas sudaro ilgos angliavandenilių grandinės, kurių viename gale yra karboksirūgšties grupė. Beveik visų organizmų ląstelių membraną iš esmės sudaro fosfolipidų dvisluoksnis - hidrofobinių riebalų rūgščių grandinių ir polinių hidrofilinių fosfatų "galvučių" grupių micelė.
Žmonėms ir daugeliui kitų gyvūnų druskos rūgštis yra skrandyje išskiriamos skrandžio rūgšties dalis. Ji gali padėti hidrolizuoti baltymus ir polisacharidus. Ji taip pat gali paversti neaktyvų profermentą pepsinogeną į fermentą pepsiną. Kai kurie organizmai rūgštis gamina gynybai, pavyzdžiui, skruzdės gamina skruzdžių rūgštį, o aštuonkojai - juodąją rūgštį, vadinamą magneta.
Daugumą rūgščių galima rasti gamtoje. Kai kurios iš jų yra šios:
- Actas yra vienas iš geriausiai žinomų; jo sudėtyje yra acto rūgšties, kuri suteikia jam gerai žinomą skonį.
- Azoto rūgštis, NHO,3 žinoma maždaug nuo XIII a.
- Citrinųrūgščių, C6 H8 O7, galima rasti įvairiuose vaisiuose. Jas tikriausiai VIII a. atrado Geberis.
- Pieno rūgštį, C3 H6 O3, 1780 m. atrado Carlas Wilhelmas Scheele. Jos yra rūgštaus pieno produktuose, pavyzdžiui, jogurte.
- Sieros rūgštį, H2 SO4, tikriausiai atrado Geberis. Šiandien jos galima rasti akumuliatoriuose.
Susiję puslapiai
- Šarmai
- Folio rūgštis
Klausimai ir atsakymai
K: Kas yra rūgštis?
A: ACID - tai straipsnis apie tam tikras duomenų bazių savybes.
K: Kas apskritai yra rūgštis?
A: Rūgštis apskritai yra medžiaga, kuri gali atiduoti vandenilio joną (H+) kitai medžiagai, o jos pH yra mažesnis nei 7,0.
K: Kokiomis sąlygomis cheminė medžiaga gali atiduoti protoną?
A: Cheminė medžiaga gali atiduoti protoną, jei vandenilio atomas yra prijungtas prie elektroneigiamo atomo, pavyzdžiui, deguonies, azoto ar chloro.
K: Kuo skiriasi stipriosios ir silpnosios rūgštys?
A: Stipriosios rūgštys atiduoda visus savo protonus, o silpnosios rūgštys dalį jų išlaiko. Pagal tai, kiek jonų išsiskiria iš vienos molekulės, sprendžiama, ar rūgštis yra silpna, ar stipri.
K: Koks yra silpnųjų ir stipriųjų rūgščių pH intervalas?
Atsakymas: Silpnųjų rūgščių pH paprastai būna 4-6, o stipriųjų rūgščių - 1-3.
K: Kas yra bazė?
A: Bazė yra rūgšties "cheminė priešingybė". Bazė yra medžiaga, kuri priima rūgšties vandenilio atomą. Bazės - tai molekulės, kurios gali skilti vandenyje ir išskirti hidroksido jonus.
K: Kas yra LSD?
A: LSD (lizerginės rūgšties dietilamidas) yra narkotikas, kuris kartais vadinamas rūgštimi, tačiau jis nėra susijęs su šiame straipsnyje minima rūgštimi.
Ieškoti