Aminorūgštys: apibrėžimas, funkcijos ir nepakeičiamos aminorūgštys
Sužinokite aminorūgščių apibrėžimą, funkcijas ir kurios yra nepakeičiamos — praktinis mitybos ir baltymų sintezės vadovas jūsų sveikatai.
Aminorūgštys yra baltymų statybinės medžiagos. Eukariotuose yra 20 standartinių aminorūgščių, iš kurių gaminami beveik visi baltymai.
Biochemijoje aminorūgštis yra bet kuri molekulė, turinti ir amino (NH+R2), ir karboksilo (C=O) funkcines grupes. Biochemijoje šis terminas reiškia alfa-amino rūgštis, kurių bendroji formulė yra H 2NCHRCOOH, kur R yra viena iš daugelio šoninių grupių (žr. schemą).
Žinoma apie 500 aminorūgščių. Gyvūnams aminorūgštys svarbiausia padeda sudaryti baltymus, kurie yra labai ilgos aminorūgščių grandinės. Kiekvienas baltymas turi savo aminorūgščių seką, dėl kurios baltymai įgauna skirtingas formas ir atlieka skirtingas funkcijas. Aminorūgštys - tai tarsi baltymų abėcėlė; nors turite tik kelias raides, jas sujungę galite sudaryti daugybę skirtingų sakinių.
Devynios iš 20 standartinių aminorūgščių yra žmogui būtinos aminorūgštys. Žmogaus organizmas negali jų pasigaminti (susintetinti) iš kitų junginių, todėl jos turi būti gaunamos su maistu. Kitos aminorūgštys gali būti būtinos tam tikro amžiaus žmonėms arba esant tam tikroms sveikatos būklėms. Nepakeičiamosios aminorūgštys taip pat gali skirtis tarp skirtingų rūšių. Žolėdžiai nepakeičiamųjų aminorūgščių turi gauti iš savo raciono, kurį sudaro beveik vien tik žolė. Atrajotojai, pavyzdžiui, karvės, kai kurias aminorūgštis gauna iš mikrobų, esančių pirmose dviejose skrandžio kamerose.
Kas dar svarbu žinoti apie aminorūgštis
Aminorūgščių cheminės savybės priklauso nuo šoninės R grupės: jos gali būti nepolinės (hidrofobinės), polinės, aromatinės, rūgštinės ar bazinės, taip pat sierą turinčios. Dauguma biologinių aminorūgščių egzistuoja kaip zwitterionai — vienu metu turi teigiamą (amino) ir neigiamą (karboksilo) krūvį, priklausomai nuo pH. Baltymų sintezėje aminorūgštys susijungia peptidinėmis jungtimis (kondensacijos reakcija, išsiskiria vanduo), sudarydamos polipeptidines grandines, kurios vėliau susilanksto į specifines sekundarines, terciarines ir kvartarines struktūras.
Funkcijos organizme
- Baltymų struktūra ir funkcija — statybinės medžiagos raumenims, fermentams, hormonams, antikūnams.
- Neproteininių molekulių ir mediatorinių medžiagų pirmtakai — pavyzdžiui, triptofanas virsta serotoninu, tyrozinas yra skydliaukės hormonų ir dopamino prekursorius, argininas — azoto oksido (NO) pirmtakas.
- Energetinis šaltinis — esant reikalui aminorūgštys gali būti skaidomos ir panaudojamos energijai arba gliukoneogenezei.
- Antioksidacinė apsauga — glutathionas, sudarytas iš glutamato, cisteino ir glicino, saugo ląsteles nuo oksidacinio streso.
- Transportas ir sandėliavimas azoto organizme.
Nepakeičiamos (esminės) aminorūgštys žmogui
Devyni aminorūgštys, kurias žmogaus organizmas negali pasigaminti ir kurių reikia gauti su maistu:
- Histidinas (histidinas)
- Izo-leucinas (izoleucinas)
- Leucinas (leucinas)
- Lizinas (lizinas)
- Metioninas (metioninas)
- Fenilalaninas (fenilalaninas)
- Treoninas (treoninas)
- Triptofanas (triptofanas)
- Valinas (valinas)
Be to, tam tikromis sąlygomis kai kurios kitos aminorūgštys tampa „sąlygiškai nepakeičiamos“ — pavyzdžiui, argininas ir cisteinas gali tapti svarbūs vaikams arba esant tam tikroms ligoms, kai sintetinimo mechanizmai nepakankami.
Klasifikacija ir genetinis kodas
20 standartinių amino rūgščių yra koduojamos DNR genetiniame kode per tripletinius kodonus mRNR. tRNR molekulės su antikodonu atneša reikiamą aminorūgštį į ribosomą, kur vyksta polipeptidų grandinės sintezė. Be šių 20, biologinėje gamtoje randama ir kitos neįprastos aminorūgštys, pavyzdžiui, selenocisteinas ir pirrolizinas, kurios tam tikrose organizmų grupėse yra įterpiamos specialiais mechanizmais.
Dieta, šaltiniai ir trūkumo pasekmės
Geri aminorūgščių šaltiniai: mėsa, žuvis, kiaušiniai, pieno produktai, sojos produktai, ankštiniai augalai, quinoa ir kai kurios riešutų bei sėklų rūšys. Augalinės kilmės baltymai kartais būna „nevisiški“ — trūksta vienos ar kelių esminių aminorūgščių — todėl rekomenduojama derinti skirtingus augalinius produktus (pvz., grūdus su ankštiniais), kad būtų gaunamas pilnas aminorūgščių spektras.
Aminorūgščių trūkumas gali sukelti augimo sulėtėjimą, raumenų silpnumą, nusilpusią imuninę funkciją ir bendrą prastą sveikatos būklę. Sunkūs baltymų trūkumo sindromai (pvz., kvashiorkoras) pasireiškia edemomis, odos ir plaukų pokyčiais bei atsparumo infekcijoms sumažėjimu.
Specialios pastabos
- Baltymai organizme naudoja tik L-aminorūgščių izomerus; D-aminorūgštys retai randamos ir daugiausia pasitaiko mikroorganizmų sienelėse ar kai kuriuose antibiotikuose.
- Aminorūgščių perteklius taip pat nėra pageidautinas — negaminti baltymai gali būti oksiduojami iki azoto šalinimo produktų arba sukaupti kaip riebalai.
- Medicinoje ir mitybos praktikoje kartais naudojami aminorūgščių papildai (pvz., sportuojantiems, reabilitacijoje), tačiau juos reikėtų vartoti atsakingai ir pasikonsultavus su specialistu.
Apibendrinant, aminorūgštys yra pagrindiniai gyvų organizmų statybiniai blokai bei metabolizmo dalyviai, turintys platų funkcijų spektrą — nuo struktūrinių baltymų formavimo iki signalinių ir metabolinių molekulių sintezės. Tinkama mityba užtikrina reikiamą tiek esminių, tiek neesminių aminorūgščių kiekį organizme.
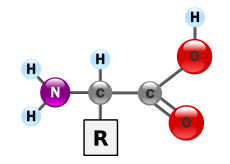
Aminorūgštys yra galutinis baltymų produktas.Bendra α-amino rūgšties struktūra: kairėje pusėje yra aminogrupė, dešinėje - karboksilo grupė.
Struktūra
Aminorūgštis yra organinė cheminė medžiaga. Ją sudaro α anglies atomas, kovalentiškai sujungtas su keturiomis grupėmis.
- vandenilio atomas
- amino grupė (-NH2)
- karboksilo grupė (-COOH)
- kintamasis R grupė
Kiekviena aminorūgštis turi bent vieną aminogrupę (-NH2) ir vieną karboksilo grupę (-COOH), išskyrus proliną.
Genų raiška ir biochemija
Tai proteogeninės aminorūgštys, iš kurių sudaryti baltymai. Jas gamina ląstelės mechanizmai, užkoduoti bet kurio organizmo genetiniame kode.
| Amino rūgštis | Trumpas | Sutrump. | Kodonas (-ai) | Paplitimas | Essential‡ žmonėms |
| A | Ala | GCU, GCC, GCA, GCG | 7.8 | Ne | |
| C | Cys | UGU, UGC | 1.9 | Sąlyginai | |
| Asparto rūgštis | D | Asp | GAU, GAC | 5.3 | Ne |
| Glutamo rūgštis | E | Glu | GAA, GAG | 6.3 | Sąlyginai |
| Fenilalaninas | F | Phe | UUU, UUC | 3.9 | Taip |
| Glicinas | G | Gly | GGU, GGC, GGA, GGG | 7.2 | Sąlyginai |
| Histidinas | H | Jo | CAU, CAC | 2.3 | Taip |
| Izoleucinas | I | Ile | AUU, AUC, AUA | 5.3 | Taip |
| Lizinas | K | Lys | AAA, AAG | 5.9 | Taip |
| Leucinas | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | Taip |
| Metioninas | M | Met | AUG | 2.3 | Taip |
| Asparaginas | N | Asn | AAU, AAC | 4.3 | Ne |
| Pirolizinas | O | Pyl | UAG* | 0 | Ne |
| Proline | P | Pro | CCU, CCC, CCA, CCG | 5.2 | Ne |
| Glutaminas | Q | Gln | CAA, CAG | 4.2 | Ne |
| Argininas | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5.1 | Sąlyginai |
| Serinas | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6.8 | Ne |
| Treoninas | T | Thr | ACU, ACC, ACA, ACG | 5.9 | Taip |
| Selenocisteinas | U | Sec | UGA** | >0 | Ne |
| Valine | V | Val | GUU, GUC, GUA, GUG | 6.6 | Taip |
| W | Trp | UGG | 1.4 | Taip | |
| Y | Tyr | UAU, UAC | 3.2 | Sąlyginai | |
| Stop kodonas† | - | Terminas | UAA, UAG, UGA†† | - | - |
* UAG paprastai yra gintarinis stop kodonas, bet koduoja piroliziną, jei yra PYLIS elementas.
** UGA paprastai yra opalinis (arba umberinis) stop kodonas, bet koduoja selenocisteiną, jei yra SECIS elementas.
† Stop kodonas nėra aminorūgštis, bet įtrauktas dėl išsamumo.
†† UAG ir UGA ne visada veikia kaip stop kodonai (žr. pirmiau).
‡ Nepakeičiamoji aminorūgštis negali būti sintetinama žmogaus organizme. Ji turi būti gaunama su maistu. Sąlyginai nepakeičiamosios aminorūgštys paprastai nėra būtinos su maistu, tačiau turi būti tiekiamos populiacijoms, kurios jų negamina pakankamai.
Su šiomis α-amino rūgštimis toliau biosintezės procesuose atsirandančios nepagrindinės rūgštys yra struktūriškai (čia naudojant SMILES užrašą) susijusios:
OC(=O)C(N)-
- ├ H .. V Glicinas
- ├ C .. P Alaninas
- │├ C .. 2-aminobutano rūgštis
- ││├ C .. Norvaline
- ││││├ -2H .. _ Prolinas (dehidronorvalinas)
- ││││├ C .. Norleucinas
- ││││└ N .. Z Lizinas
- ││││ └ C(=O)C1N=CCC1C .. ^ Pirolizinas
- ││││└ NC(=N)N .. a Argininas
- │││├ C(=O)N .. ` Glutaminas
- │││├ C(=O)O .. T Glutamo rūgštis
- │││├ O .. Homoserinas
- │││└ S .. Homocisteinas
- ││ └ C .. \ Metioninas
- │├ C(C)C .. [ Leucinas
- │├ C(=O)N .. ] Asparaginas
- │├ C(=O)O .. S Asparto rūgštis
- │├ C1=CNC=N1 .. W Histidinas
- │├ c1ccccc1 .. U Fenilalaninas
- │├ c1ccc(O)cc1 .. h tirozinas
- │├ C1=CNc2ccccc12 .. f triptofanas
- │├ C1=CNc2ccc(O)cc12 .. Oksitriptanas
- │├ c(cc1I)cc(I)c1-O-c2cc(I)c(O)c(I)c2 .. Tiroksinas
- │├ O .. b Serinas
- │├ S .. R Cisteinas
- │└ [SeH] .. d Selenocisteinas
- ├ C(C)C .. e Valinas
- ├ C(C)O .. c Treoninas
- └ C(C)CC .. X Izoleucinas
Klausimai ir atsakymai
K: Kas yra aminorūgštys?
A: Aminorūgštys - tai molekulės, turinčios ir amino (NH2+R), ir karboksilo (C=O) funkcines grupes, ir jos yra baltymų sudedamosios dalys.
K: Kiek "standartinių" aminorūgščių yra eukariotuose?
A: Eukariotuose yra 20 "standartinių" aminorūgščių, iš kurių sudaryti beveik visi baltymai.
K: Kokia yra bendroji alfa aminorūgščių formulė?
A: Bendroji alfa-amino rūgščių formulė yra H2NCHRCOOH, kur R yra viena iš daugelio šoninių grupių.
K: Apie ką kalbama biochemijoje, kai minimos aminorūgštys?
A: Biochemijoje terminas "aminorūgštis" reiškia alfa-amino rūgštis, kurių bendroji formulė yra H2NCHRCOOH, kur R yra viena iš daugelio šoninių grupių.
K: Kaip baltymai įgauna savo struktūrą?
A: Baltymų struktūrą lemia įvairių rūšių aminorūgščių derinys.
K: Kokį vaidmenį aminų ir karboksilo funkcinės grupės atlieka aminorūgščių molekulėje?
A: Amino ir karboksilo funkcinės grupės sudaro aminorūgščių molekulę; jos suteikia azoto atomą ir anglies atomą, kurie gali sudaryti ryšius su kitomis molekulėmis.
Ieškoti