Baltymų lankstymasis: apibrėžimas, mechanizmai ir reikšmė
Baltymų lankstymasis: aiškus apibrėžimas, mechanizmai ir reikšmė sveikatai — nuo molekulinių etapų ir funkcijos iki neteisingo lankstymosi sukeltų ligų ir imuninės reakcijos.
Baltymų lankstymasis yra procesas, kurio metu baltymas įgauna savo funkcinę formą arba "konformaciją". Tai daugiausia savaiminis procesas. Iš atsitiktinės ritės polipeptidai susilanksto į jiems būdingą darbinę formą. Šią struktūrą sulaiko vandeniliniai ryšiai.
Etapai yra šie:
- Kiekvienas baltymas, kai iš mRNA sekos verčiamas į linijinę aminorūgščių grandinę, egzistuoja kaip neišsiskleidęs polipeptidas arba atsitiktinė ritė. Šis polipeptidas neturi jokios išvystytos trimatės struktūros (kairėje viršutinio paveikslėlio pusėje).
- Aminorūgštys sąveikauja tarpusavyje ir sukuria aiškiai apibrėžtą trimatę struktūrą - sulankstytą baltymą (dešinėje paveikslėlio pusėje). Ši būsena vadinama savąja būkle. Susidariusią trimatę struktūrą lemia aminorūgščių seka (Anfinseno dogma).
Be tinkamos trimatės struktūros baltymas neveikia. Tačiau kai kurios baltymų dalys gali nesusilankstyti: tai normalu.
Jei baltymai nesusilanksto į savo prigimtinę formą, jie yra neaktyvūs ir paprastai toksiški. Manoma, kad kai kurias ligas sukelia neteisingai susilankstę baltymai. Daugelį alergijų sukelia baltymų lankstymasis, nes imuninė sistema negamina antikūnų visoms galimoms baltymų struktūroms.
Mechanizmai ir energetinis peizažas
Baltymo lankstymasis vyksta per daugiaetapius tarpinės būsenas — nuo atsitiktinės ritės iki pilnai sulankstytos natūralios konformacijos. Procesą nulemia fizikinės jėgos: vandeniliniai ryšiai, joniniai ryšiai, Van der Waals sąveikos ir hidrofobiniai efektai. Dėl hidrofobinių aminorūgščių polipeptidas dažnai „surandą“ konformaciją, kurioje hidrofobiniai paviršiai yra paslėpti viduje, o hidrofiliniai — išorėje.
Frazė „energetinis peizažas“ (energy landscape) apibūdina, kad lankstymasis nėra vienas trajektorijos kelias, o daug galimų kelių, kuriuos polipeptidas gali pereiti link žemiausios energijos būklės. Kai kuriems baltymams procesas yra greitas ir monotoniškas, kiti gali patekti į pastovias tarpines arba klaidingas (misfolded) būsenas.
Kofaktoriai, chaperonai ir ko- bei post- translaciniai procesai
Ne visi baltymai susilanksto tik savaime. Lankstymą dažnai palengvina arba koreguoja kitos molekulės:
- Ribosominis ir ko-transliacinis lankstymasis: dalis baltymų pradeda lankstytis dar kol transliacija vyksta, todėl seka ir tempas įtakoja galutinę struktūrą.
- Chaperonai: baltymų chaperonai (pvz., Hsp70 šeima, chaperoninai GroEL/GroES bakterijose arba TRiC eukariotams) padeda išvengti neteisingų sąveikų ir suteikia tinkamą aplinką teisingam lankstymuisi. Jie neperprogramuoja seka lemiamo „Anfinseno“ principo, bet padeda kinetiškai pasiekti natūralią būklę.
- Ko-faktoriai ir jonai: metalai (pvz., Zn2+, Fe2+/3+) arba kofaktoriai (vitaminai, koenzimai) yra būtini kai kuriems baltymams stabilizuoti aktyvias vietas.
- Post-transliacinės modifikacijos: fosforilinimas, glikozilinimas, disulfidų tilteliai ir kitos modifikacijos gali būti būtinos stabilumui arba funkcijai, ypač sekretuojamiems arba membraniniams baltymams.
Misfoldingas, agregacija ir ligos
Neteisingai susilankstyti baltymai gali agreguotis į oligomerus arba fibriles. Tokios agregacijos yra susijusios su daugybe neurodegeneracinių ligų: Alzheimerio ligos (β-amyloid ir tau), Parkinsono (α-synuclein), Huntingtono (mutantinio huntingtino) ir prioninių ligų atvejais. Kai kurie neteisingai susiformavę tarpiniai produktai yra toksinesni už dideles agreguotas struktūras.
Organizme egzistuoja kokybinės kontrolės mechanizmai: prarasti ar misfolded baltymai pažymimi ubikvitinu ir išardomi proteasomomis arba pašalinami per autofagiją. Šių sistemų sutrikimai lemia proteostazės (baltymų namų ūkio) gedimus ir ligų progresavimą.
Intrinsiškai nenuoseklūs baltymai
Ne visi baltymai turi vieną stabilų „natūralų“ konformaciją. Intrinsiškai nenuoseklūs arba nepernešami baltymų regionai (IDP, intrinsically disordered proteins) išlieka lankstūs ir įgyja struktūrą tik sąveikaujant su partneriais arba esant tam tikroms sąlygoms. Tokie regionai atlieka svarbias reguliacines funkcijas ir nėra laikomi klaidingai susilankstytais.
Studijų metodai ir eksperimentinė analizė
Baltymų struktūras ir lankstymosi procesus tiria įvairūs metodai:
- Rentgeno difrakcija (X-ray crystallography), NMR ir cryo-EM — trimatėms struktūroms nustatyti.
- Dinaminiai metodai: circular dichroism (CD), fluorescencijos spektroskopija, FRET, stop-flow ir kinetiniai matavimai — lankstymosi kinetikai ir proceso tarpiniams produktams stebėti.
- Biocheminiai tyrimai: mutacijų analizė, termostabilumo matavimai (DSC), analitinė ultracentrifugacija — baltymų stabilumui ir agregacijos tendencijoms vertinti.
Reikšmė biologijoje ir medicinoje
Teisingas baltymų lankstymasis yra būtinas ląstelės funkcijai: fermentų aktyvumas, signalų perdavimas, struktūriniai komponentai ir medžiagų pernaša priklauso nuo tinkamos konformacijos. Lankstymosi sutrikimai sukelia ląstelių disfunkciją ir prisideda prie ligų, todėl supratimas apie šiuos procesus leidžia kurti terapijas:
- Chaperonų moduliatoriai ar mažinamosios medžiagos, mažinančios agregaciją, yra aktyviai tiriami kaip gydymo strategijos neurodegeneracinėms ligoms.
- Gydymo taktikos gali apimti stabilizatorius, kurie fiksuoja baltymą natūralioje konformacijoje, arba skatinimą degradacinių kelių (pvz., PROTAC technologija), kad pašalintų toksiškus baltymus.
Praktiniai pastebėjimai ir išvados
Baltymų lankstymasis — dinamiškas, daugialypis ir svarbus biologinis procesas. Nors šiame tekste pabrėžta, kad daug baltymų gali susilankstyti savaime (kaip nurodo Anfinseno dogma), realioje ląstelėje procesas dažnai remiasi chaperonais, kofaktoriais bei kokybės kontrole. Tyrinėjant lankstymą, būtina atsižvelgti į kinetiką, termodinamiką ir ląstelės kontekstą.
Supratimas apie šiuos mechanizmus svarbus ne tik fundamentinei biologijai, bet ir biotechnologijai bei medicinai — nuo baltymų inžinerijos iki ligų prevencijos ir gydymo.
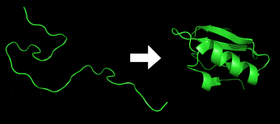
Baltymai prieš ir po sulankstymo
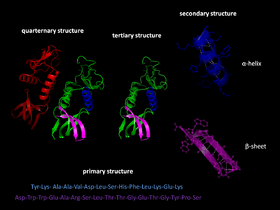
Baltymų lankstymas yra trečiasis baltymų struktūros vystymosi etapas.
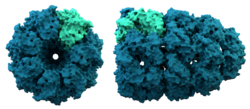
Šaperonino struktūra. Šaperoninai padeda lankstytis kai kuriems baltymams.
Šaperonai
Šaperoninai - tai dideli baltymai, kurie po sintezės padeda sulankstyti kai kuriuos baltymus. Apskritai šaperonai pirmą kartą buvo atrasti padedantys histonams ir DNR susijungti į nukleosomas. Nukleosomos yra chromosomų pagrindas. Dabar jau aišku, kad taip yra sudarytos daugelis ląstelės organelių.
Klausimai ir atsakymai
K: Kas yra baltymų sulankstymas?
A: Baltymų lankstymasis yra procesas, kurio metu polipeptidinė grandinė iš nesulankstytos linijinės aminorūgščių grandinės virsta į jai būdingą trimatę formą.
K: Kas išlaiko struktūrą?
A: Sulankstyto baltymo struktūrą laiko vandeniliniai ryšiai.
K: Kokie yra baltymų lankstymo etapai?
A: Baltymų lankstymo etapai apima nesulankstytą polipeptidą arba atsitiktinę spiralę, kai iš mRNA išverčiama į linijinę aminorūgščių grandinę, o tada sąveikauja tarpusavyje, kad susidarytų gerai apibrėžta trimatė struktūra, vadinama prigimtine būsena.
Klausimas: Kas atsitinka, jei baltymai susilanksto neteisingai?
A: Jei baltymai nesusilanksto į savo prigimtinę formą, jie yra neaktyvūs ir paprastai toksiški. Dėl to gali atsirasti keletas ligų ir alergijų, kurias sukelia neteisingai sulankstyti baltymai, kurių imuninė sistema neatpažįsta.
K: Kas išsprendė baltymų lankstymo problemą 2020 m.?
Atsakymas: 2020 m. lapkričio 30 d. baltymų lankstymo problemą išsprendė dirbtinio intelekto bendrovė "DeepMind".
K: Kas yra Anfinseno dogma? A: Anfinseno dogma teigia, kad sulankstyto baltymo trimatę struktūrą lemia jo aminorūgščių seka.
Ieškoti