Benzenas (benzolas): kas tai, savybės, panaudojimas ir pavojai
Benzenas (benzolas): kas tai, savybės, panaudojimas ir pavojai — sužinokite apie jo chemiją, pramoninį panaudojimą, tirpiklio vaidmenį ir kancerogeninius rizikos veiksnius.
Benzenas, dar vadinamas benzolu, yra organinis cheminis junginys, kurio formulė 6CH6. Tai bespalvis ir degus, saldaus kvapo skystis. Benzeno molekulės yra žiedas iš šešių anglies atomų, kurių kiekvienas yra sujungtas su vienu vandenilio atomu. Tai aromatinis junginys, t. y. žiedas turi pakaitomis besikeičiančių dvigubų ryšių.
Benzenas yra kancerogeninis, t. y. gali sukelti vėžį. Jis daug kur naudojamas realiame pasaulyje. Jis naudojamas kaip benzino, plastikų, sintetinio kaučiuko, dažiklių priedas ir yra pramoninis tirpiklis, t. y. gali ištirpinti daugelį kitų cheminių molekulių. Benzenas taip pat yra natūrali žalios naftos dalis, todėl jo yra benzine. Daugelio vaistų sudėtyje yra dalių, pagamintų iš benzeno.
Struktūra ir pagrindinės fizikinės savybės
Benzeno molekulė yra plokščias ciklinis žiedas, kuriame elektronai delokalizuoti per visą žiedą — tai suteikia stabilų aromatinį charakterį. Tradiciškai struktūra vaizduojama kaip šešiakampis su besikeičiančiais viengubais ir dvigubais ryšiais arba kaip šešiakampis su apskritimu, žyminčiu delokalizuotus π-elektronus.
- Formulė: C6H6 (taip pat atspindėta originaliame tekste kaip CH6 su subscript žymėjimu).
- Fizinė būsena: bespalvis skystis kambario temperatūroje.
- Virimo temperatūra: apie 80,1 °C.
- Lydymosi temperatūra: apie 5,5 °C.
- Tankis: apie 0,876 g/cm³ (20 °C).
- Kvapas: saldus, specifinis, atpažįstamas net mažomis koncentracijomis.
Gamyba ir natūralūs šaltiniai
Pramonėje benzenas dažniausiai gaunamas iš naftos per destiliaciją ir katalizinį reformavimą, taip pat kaip šalutinis produktas naftos perdirbimo procesuose. Benzeno šaltiniai natūralioje aplinkoje — žalia nafta ir tam tikros biocheminės reakcijos. Taip pat benzenas gali susidaryti degimo procesuose ir būti oro taršos komponentu.
Panaudojimas
Benzenas yra svarbus pramoninis žaliavas šių produktų gamyboje:
- styreno (toliau – polistirolo),
- fenolio ir cumeno gamybai,
- anilinų (vaistų, dažiklių, pigmentų pramonėje),
- plastikų ir sintetinio kaučiuko priedas,
- tirpiklis laboratorijose ir pramonėje (nors dėl toksiškumo vis dažniau keičiamas saugesniais tirpikliais),
- benzinas ir kiti degalai — benzenas natūraliai randamas angliavandenilių mišiniuose.
Pavojai ir poveikis sveikatai
Benzenas yra pripažintas žmogaus kancerogenas (IARC – grupė 1). Ilgalaikė arba didesnė benzenu dirbančių žmonių eksponavimo rizika apima:
- kaulų čiulpų slopinimą, kraujodaros sutrikimus (pvz., aplastinę anemiją),
- padidėjusią tam tikrų leukemijų, ypač ūmią mieloblestinę leukemiją (AML), riziką,
- lėtines kvėpavimo takų, nervų sistemos ir imuninės sistemos problemas.
Ūminis poveikis (esant didelėms koncentracijoms) gali sukelti galvos skausmą, svaigulį, pykinimą, sąmonės praradimą ir kvėpavimo sutrikimus. Benzenu galima prisigerti per kvėpavimą, odą arba virškinimo traktą.
Aplinkos rizikos ir elgsena aplinkoje
- Benzenas yra laki ir gerai garuoja; jis yra vienas iš priskiriamų VOC (lot. volatile organic compounds), todėl prisideda prie oro taršos ir žemutinio sluoksnio ozono susidarymo.
- Grunto ir požeminio vandens užteršimas benzeno gali būti ilgalaikis problema — tam tikri mikroorganizmai skaido benzeną, tačiau anaerobinėse sąlygose skilimas sulėtėja.
- Benzenas bioakumuliuojasi mažiau nei riebaluose tirpios medžiagos, bet dėl toksinio poveikio net mažos koncentracijos gali būti pavojingos.
Apsauga, prevencija ir pirmoji pagalba
- Darbo vietose būtina taikyti inžinerines priemones: ventiliaciją, uždarus procesus, garų surinkimo sistemas.
- Naudoti asmenines apsaugos priemones: respiratorius (kai reikalinga), apsauginę aprangą ir apsaugines pirštines, apsauginius akinius.
- Laikyti benzeną uždarytose, vėsiose, gerai vėdinamose patalpose, toliau nuo atviros ugnies ir šilumos šaltinių; saugoti nuo tiesioginių saulės spindulių.
- Įvykus įkvėpimui — nešti nukentėjusįjį į gryną orą, palaikyti kvėpavimą ir kreiptis į medikus. Esant odos sąlyčiui — nuplauti muilu ir vandeniu; jei ant drabužių — kuo greičiau juos nusiimti.
Reguliavimas ir ribinės vertės
Dėl didelio kancerogeninio potencialo daugelis šalių griežtai reguliuoja benzenu dirbančių grupių saugą, apriboja benzenu užteršto benzino kiekį ir nustato darbo aplinkos ekspozicijos ribas. Konkrečias ribines vertes ir standartus rekomenduojama tikrinti pagal savo šalies institucijų (pvz., aplinkos, sveikatos ir darbo saugos) rekomendacijas.
Atliekų tvarkymas ir alternatyvos
Benzeno turinčias atliekas reikia tvarkyti pagal pavojingų cheminių medžiagų taisykles: surinkti, pažymėti ir pristatyti į tinkamai licencijuotas atliekų tvarkymo įmones. Pramonėje siekiama mažinti benzeno naudojimą keisti jį mažiau toksiškais tirpikliais ar kitais žaliavų šaltiniais; taip pat diegiamos technologijos, leidžiančios sumazinti emisijas.
Išvados
Benzenas yra svarbi cheminė žaliava ir plačiai naudojamas pramonėje, tačiau dėl savo toksiškumo ir kancerogeninių savybių reikalauja griežtos kontrolės, saugios eksploatacijos ir alternatyvų paieškos. Informacija apie konkrečius saugos reikalavimus, ekspozicijos ribas ir atliekų tvarkymą turi būti gaunama iš oficialių šaltinių ir pritaikoma pagal vietinius teisės aktus.
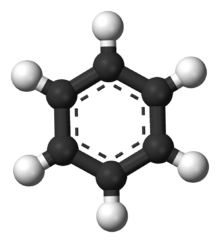
Benzeno molekulės modelis. Anglies atomai pavaizduoti juodai, o vandenilio - baltai.
_1964,_MiNr_440.jpg)
1964 m. Vokietijos paštas išleido pašto ženklą, skirtą benzeno atradimo 100-mečiui paminėti.
Struktūra
Benzenas pasižymi ypatingomis savybėmis, vadinamomis aromatiškumu. Visi šeši anglies atomai žiede yra toje pačioje plokštumoje. Kad būtų galima paaiškinti visas šešių anglies atomų žiedo jungtis, turi būti pakaitomis besikeičiančios dvigubos anglies jungtys (konjuguota sistema):
Jei benzenas turėtų tris dvigubas jungtis, trys jo žiedo pusės būtų trumpesnės už kitas tris puses. Rentgeno spindulių difrakcija rodo, kad visos šešios benzeno anglies ir anglies jungtys yra vienodo 140 pikometrų (pm) ilgio. C-C ryšio ilgis yra didesnis nei dvigubo ryšio (135 pm), bet trumpesnis nei viengubo ryšio (147 pm). Šis tarpinis atstumas atitinka elektronų delokalizaciją: C-C ryšio elektronai pasiskirsto po lygiai tarp kiekvieno iš šešių anglies atomų. Molekulė yra plokščia. Vienas iš vaizdinių rodo, kad struktūra egzistuoja kaip vadinamųjų rezonansinių struktūrų superpozicija, o ne kuri nors iš formų atskirai. (Kitaip tariant, molekulės dvigubos jungtys greitai persijungia tarp anglies atomų porų). Elektronų delokalizacija yra vienas iš benzeno ir giminingų aromatinių junginių termodinaminio stabilumo paaiškinimų. Tikėtina, kad šis stabilumas lemia ypatingas molekulines ir chemines savybes, vadinamas aromatiškumu. Norint parodyti delokalizuotą ryšio pobūdį, benzenas dažnai vaizduojamas apskritimu, esančiu anglies atomų šešiakampio išsidėstymo viduje.
Kaip įprasta organinėje chemijoje, pirmiau pateiktoje schemoje anglies atomai nepažymėti. Kadangi kiekviena anglis turi 2p elektronų, kiekviena anglis atiduoda po elektroną į delokalizuotą žiedą virš ir po benzeno žiedu. Būtent p orbitų persidengimas virš ir po žiedu sukuria pi debesis.
1986 m. žurnale "Nature" paskelbtame straipsnyje kai kurie chemikai paneigė delokalizuoto benzeno požiūrį. Jie parodė, kad benzeno elektronai beveik neabejotinai yra lokalizuoti prie tam tikrų anglies atomų. Jie įrodė, kad benzeno aromatinės savybės atsiranda dėl sukinio ryšio, o ne dėl elektronų delokalizacijos. Kiti mokslininkai 1987 m. žurnale "Nature" parašė straipsnius, patvirtinančius šią nuomonę. Tačiau chemikai neskubėjo atsisakyti delokalizuotų elektronų požiūrio.
Benzeno dariniai pakankamai dažnai pasitaiko kaip organinių molekulių sudedamoji dalis, todėl įvairių techninių elementų bloke yra Unikodo simbolis su kodu U+232C (⌬), reiškiantis benzeną su trimis dvigubomis jungtimis, ir U+23E3 (⏣), reiškiantis delokalizuotą versiją.
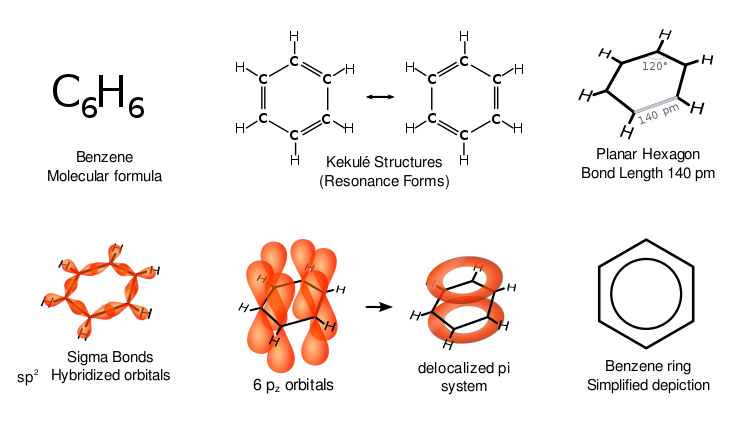
Įvairūs benzeno atvaizdai
Klausimai ir atsakymai
K: Kas yra benzenas?
A: Benzenas yra organinis cheminis junginys.
K: Kokia yra benzeno cheminė formulė?
A: Cheminė benzeno formulė yra C6H6.
K: Kaip atrodo ir koks yra benzeno kvapas?
A: Benzenas yra bespalvis ir degus, saldaus kvapo skystis.
K: Kokia yra benzeno molekulės struktūra?
A: Benzeno molekulė yra žiedas, sudarytas iš šešių anglies atomų, kurių kiekvienas yra sujungtas su vienu vandenilio atomu. Tai aromatinis junginys, t. y. žiedas turi pakaitomis besikeičiančias dvigubas jungtis.
K: Ar benzenas yra kancerogeniškas?
Atsakymas: Taip, benzenas yra kancerogeniškas, t. y. gali sukelti vėžį.
K: Kaip benzenas naudojamas realiame pasaulyje?
A: Benzenas naudojamas kaip benzino, plastikų, sintetinio kaučiuko, dažiklių priedas ir yra pramoninis tirpiklis, t. y. gali ištirpinti daugelį kitų cheminių molekulių. Daugelio vaistų sudėtyje taip pat yra dalių, pagamintų iš benzeno.
K: Kur randamas benzenas?
A: Benzenas yra natūrali žalios naftos dalis, todėl jo yra benzine.
Ieškoti