Konjuguotos sistemos (konjugacija) — apibrėžimas, savybės, pavyzdžiai
Konjuguotos sistemos (konjugacija) — aiškus apibrėžimas, savybės ir praktiniai pavyzdžiai: delokalizuoti π-elektronai, stabilumas, spektroskopija ir pramoninis pritaikymas.
Chemijoje konjuguota sistema yra kelių gretimų p-orbitalių persidengimo sritis, kurioje pi elektronai yra delokalizuoti — tai reiškia, kad elektronai nepriklauso vienam viengubam ryšiui ar atomui, o yra pasiskirstę per visą atomų grupę. Konjuguotas sistemas dažniausiai sudaro kelios daugybinės jungtys (dvigubos arba trigubos), atskirtos viengubomis jungtimis, tačiau jose taip pat gali dalyvauti vienišos poros, radikalai arba karbeno jonai. Tokios sistemos sumažina bendrąsias molekulės energiją ir padidina jos pastovumą dėl elektronų delokalizacijos.
Kaip veikia konjugacija
Konjugacija reiškia vienos p-orbitalės persidengimą su kita per tarp jų esantį sigma ryšį (viengubą ryšį). Kai gretimos p-orbitalės yra sulygiuotos ir persidengia, jos sudaro didesnę pi elektronų debesies sritį, leidžiančią elektronams laisvai judėti tarp kelių atomų. (Didesnių atomų d-orbitalės taip pat gali prisidėti prie konjuguotos sistemos — tai ypač reikšminga pereinamųjų elementų junginiuose.)
Struktūros tipai
- Linijinė (alifatinė) konjugacija: pvz., 1,3-butadienas — dviejų ar daugiau dvigubų jungčių seka, atskiros viengubomis jungtimis.
- Ciklinė konjugacija: ciklinės sistemos (pvz., benzenas) gali tapti aromatinėmis, jei atitinka tam tikras sąlygas (žr. žemiau).
- Kryžminė (cross-conjugation): kai viena dviguba jungtis yra konjuguota su dviem kitomis, bet tos dvi kitos ne konjuguotos tarpusavyje.
- Kumuliuota sistema: kai daugybinės jungtys eina iš eilės be viengubų jungčių (pvz., allenai) — tai nėra tikroji konjugacija, nes p-orbitalės gali būti orientuotos kitaip.
Aromatinė konjuguota sistema ir Hückelio taisyklė
Ciklinės konjuguotos sistemos gali būti aromatinės, jei jos turi delokalizuotų pi elektronų, atitinkančių Hückelio taisyklę: 4n + 2 π elektronų (n = 0, 1, 2…). Aromatinės molekulės, pavyzdžiui, grafitas (lokaliai grafeno sluoksniuose) ir benzenas, gauna papildomą stabilizaciją — vadinamą rezonansine arba aromatine energija — dėl uždaro delokalizuoto π elektrono rato.
Savybės ir pasekmės
- Stabilumas: delokalizacija sumažina molekulės energiją, stabilizuoja tarpininkus (pvz., allyl katijoną, enolatą) ir radikalus.
- Elektroninė savybė: konjuguotos sistemos turi mažesnį HOMO–LUMO energijų skirtumą, todėl lengviau absorbuoja šviesą — tai suteikia spalvą dažų ir konjuguotų pigmentų.
- Cheminis aktyvumas: konjuguoti alkenai reaguoja kitaip nei izoliuotos dvigubos jungtys — pavyzdžiui, 1,3-butadienas gali dalyvauti Dielso–Alderio reakcijose; konjuguoti junginiai slopina paprastą elektrofilinę addiciją ir gali stabilizuoti karbokations.
- Aktyvumas rūgštingumui ir bazingumui: delokalizacija gali padidinti vandenilio rūgšties aktyvumą (pvz., α vandeniliai prie ketonų ar enonų) arba stabilizuoti konjuguotus anijonus (enolatai).
- Elektrinė laidumas: ilgų konjuguotų polimerų ir grafeno tipo medžiagų delokalizuoti elektronai suteikia laidumą — tai pagrindas laidžiems polimerams ir organinei elektronikai.
Pavyzdžiai
- 1,3-Butadienas: paprastas liniškas konjuguotas dienas, naudojamas iliustruoti delokalizaciją ir grandininės polimerizacijos reakcijas.
- Benzenas: klasikinė aromatinė konjuguota sistema su 6 π elektronais (stabilus dėl rezonansinės delokalizacijos).
- Alilinis kationas/anionas: trijų atomų konjuguota sistema, kurioje krūvis yra delokalizuotas per tris atomus, stabilizuodamas tarpininką.
- Enonai (pvz., akroleinas): konjugacija tarp π sistemos ir karbonilo grupės suteikia specifinę reaktivitę (konjuguota addicija).
- Didžiausios konjuguotos sistemos: tokios, kaip grafite, laidžiuose polimeruose ir anglies nanovamzdeliuose, turi labai platų delokalizuotų elektronų tinklą ir specifines mechanines bei elektrines savybes.
Spektriniai ir analitiniai požymiai
Konjuguotos sistemos dažnai rodo poslinkį į ilgesnę bangos ilgį UV–Vis spektre (vadinamą hypso- arba bathochrominiu poslinkiu), lyginant su izoliuotomis dvigubomis jungtimis. Taip pat konjuguotų junginių struktūrą galima tirti infraraudonųjų spindulių (IR) spectroscopy, NMR (rezonansinė spektroskopija) ir rentgeno kristalografija.
Praktinė reikšmė
- Dalyvauja kuriant dažus, pigmentus ir konjuguotus organinius puslaidininkius.
- Turi svarbų vaidmenį biocheminėse molekulėse (pvz., pigmentuose, chromoforuose) ir sintetiniuose reagentuose.
- Naudojama nanotechnologijose — konjuguotos anglies formos (grafenas, nanovamzdeliai) yra svarbios dėl savo mechaninių, elektrinių ir šilumos savybių.
Apibendrinant: konjugacija yra svarbi cheminė savybė, kuri keičia molekulių energiją, reaktivitę, spektrines charakteristikas ir panaudojimą technologijose. Ji kyla iš p-orbitalių persidengimo ir elektronų delokalizacijos per kelis atomus ar visą ciklinį ratą.

Cinamaldehidas, fenolinis junginys su konjuguota sistema
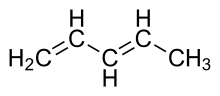
1,3-pentadienas
Mechanizmas
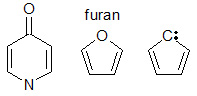
Konjugaciją gali sukelti įvairių tipų molekulinės struktūros. Kad būtų galima konjugacija, visi kaimyniniai atomai grandinėje turi turėti laisvą p orbitalę. Daugeliu atvejų konjuguotos sistemos yra viengubų ryšių, po kiekvieno kurių seka dvigubas ryšys, eilė. Egzistuoja ir kitų sistemų. Pavyzdžiui, furanas (žr. paveikslėlį) yra penkių narių žiedas su dviem pakaitomis besikeičiančiomis dvigubomis jungtimis ir deguonimi 1 padėtyje. Furano deguonis turi dvi vienišas poras, kurių viena užpildo p-orbitalę toje padėtyje. Dėl vienišos elektronų poros penkių narių žiede galima konjugacija. Žiede esantis azotas gali būti pi orbitalės, reikalingos konjugacijai, šaltinis. Be to, pi orbitalės, reikalingos konjugacijai, gali būti gaunamos iš α pakaitinių grupių, pavyzdžiui, karbonilo grupės (C=O), imino grupės (C=N), vinilo grupės (C=C) arba anijono.
Chromoforai
Pagrindinės chromoforus sudarančios medžiagos yra konjuguotos sistemos. Chromoforai - tai šviesą sugeriančios molekulės dalys, dėl kurių junginys gali įgauti matomą spalvą. Chromoforų dažnai būna įvairiuose organiniuose junginiuose, o kartais jų būna polimeruose, kurie yra spalvoti arba švyti tamsoje. Chromoforus dažnai sudaro konjuguotų ryšių ir (arba) žiedų sistemos, kuriose gali būti C-C, C=C, C=O arba N=N ryšių. Dažnai chromoforai turi aromatinius žiedus.
Konjugacija su įvairių rūšių p-orbitalių donorinėmis grupėmis
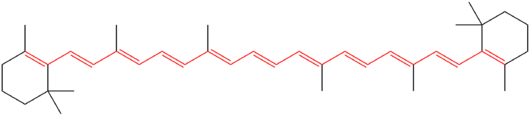
Cheminė beta karotino struktūra. Vienuolika konjuguotų dvigubų ryšių, sudarančių molekulės chromoforą, pažymėti raudonai.
Bendrieji pavyzdžiai
Susiję puslapiai
- Rezonansas (chemija)
- Hiperkonjugacija
- Kryžminė konjugacija
- Polenai
Klausimai ir atsakymai
K: Kas chemijoje yra konjuguota sistema?
A: Konjuguota sistema - tai ištisinių ir lygiagrečių p-orbitalių su delokalizuotais elektronais sistema.
K: Kaip sukuriamos konjuguotos sistemos?
A: Konjuguotas sistemas sukuria kelios daugybinės jungtys, kurių kiekvieną skiria viengubos jungtys.
K: Ką galima rasti konjuguotoje sistemoje?
A: Konjuguotose sistemose gali būti vienišų porų, radikalų arba karbonio jonų.
K: Ar junginys su konjuguota sistema gali būti ciklinis?
A: Taip, junginys su konjuguota sistema gali būti ciklinis, aciklinis, linijinis arba mišrus.
K: Kokiomis unikaliomis savybėmis pasižymi molekulės su konjuguota sistema?
A: Molekulės su konjuguota sistema pasižymi unikaliomis savybėmis, besiskiriančiomis nuo įprastų junginių, kurias sukuria delokalizuotų elektronų pasidalijimas tarp daugelio atomų.
Klausimas: Koks yra persidengimas, susijęs su konjugacija?
A: Konjugacija - tai vienos p-orbitalės persidengimas su kita per tarp jų esantį sigma ryšį (arba vieną ryšį).
K: Kur randamos didžiausios konjuguotos sistemos?
A.: Didžiausios konjuguotos sistemos (su didžiausiu bendrų elektronų skaičiumi) yra grafite, laidžiuose polimeruose ir anglies nanovamzdeliuose.
Ieškoti