Pi ryšiai (π) chemijoje: apibrėžimas, savybės ir pavyzdžiai
Sužinokite apie π ryšius chemijoje: apibrėžimą, orbitalių savybes, stabilumą ir pavyzdžius. Aiškūs paaiškinimai ir iliustracijos studentams bei mokslininkams.
Chemijoje pi ryšiai (π ryšiai) — tai vienas iš pagrindinių kovalentinių cheminių ryšių tipų, susidarantis, kai dvi atomų elektrono orbitos persidengia šonu (side-on overlap). Skirtingai nuo sigma (σ) ryšio, kuriame orbitos persidengia tiesiogiai tarp branduolių, pi ryšio elektronų tankis koncentruojasi virš ir po junginio ašimi, o per pačią junginio ašį esanti plokštuma dažnai yra mazginė (neužpildyta elektronų). Elektronų keliai p orbitalėse primena „aštuoniukės“ formą (žr. paveikslėlį). Dėl šio šoninio persidengimo susidaro dvi atskiros persidengimo sritys — viršuje ir apačioje.
Kaip susidaro π ryšiai
Pi ryšiai dažniausiai susidaro iš paraleliaus p orbitalių persidengimo. Todėl graikiška raidė π jų pavadinime nurodo p orbitales. Pi ryšio orbitalių simetrija, žiūrint išilgai junginio ašies, atitinka p orbitalių simetriją. Praktikoje pi ryšiai yra tipiški dvigubiems ir trigubiems ryšiams: vienas dvigubo ryšio komponentas yra σ ryšys, o antras — π ryšys; trigubame ryšyje — vienas σ ir du π ryšiai. Pastaba: kai kuriose teorijose pi tipo sąveikos svarbios ir d orbitalėse, ypač pereinamųjų metalų cheminių ryšių aprašyme.
Savybės ir lyginimas su σ ryšiais
- Persidengimo pobūdis: π ryšiuose orbitų keliai yra lygiagretūs ir persidengimas yra šoninis; dėl to kvantinė mechanika rodo, kad π persidengimas paprastai mažesnis nei σ persidengimas.
- Stiprumas: pavieniui π ryšys yra silpnesnis nei σ ryšys, tačiau kai kartu yra σ + π (pvz., dvigubame ryšyje), bendras ryšys stipresnis ir trumpesnis už vienkartinį ryšį.
- Bond length ir energija: papildomas π komponentas sumažina tarpatominį atstumą ir padidina ryšio energiją, todėl dvigubi/trigubi ryšiai yra trumpesni ir stipresni nei vienkartiniai.
- Sukimosi apribojimas: molekuliniai fragmentai, sujungti π ryšiu, negali laisvai suktis apie tą ryšį nenutraukdami π komponento — Sukimasis priverstų p orbitalius prarasti lygiagrečią orientaciją ir sunaikintų π persidengimą.
- Reaktyvumas: π elektronai yra paprastai labiau „išorėje“ ir lengviau prieinami, todėl π ryšiai yra dažni taikiniai elektrofilinių reakcijų (pvz., alkenų elektrofilinė adicija).
- Orbitaliniai terminai: pi ryšio susidarymą ir savybes apibūdina ir π (bonding) bei π* (antibonding) molekulinės orbitalės; π→π* pereinamai lemia UV–Vis absorbcijas.
Konjugacija, rezonansas ir delokalizacija
Kai π ryšiai kitoje struktūroje yra išsidėstę vienas po kito (pvz., konjuguoti dvigubi ryšiai arba aromatinės sistemos), jų π orbitalės gali sudaryti bendrą delokalizuotą π elektronų sistemą. Tai lemia papildomą stabilizaciją (rezonansą), pokyčius elektronų tankyje ir specifiškesnes chemines savybes. Pavyzdžiui, benzenas turi delokalizuotą π elektroniką, dėl ko jis yra ypač stabilus ir elgiasi kitaip nei vien izoliuoti alkenai.
Pavyzdžiai
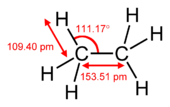
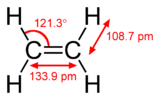
- Etenas (C2H4): kiekviename anglies tarpe yra vienas σ ir vienas π ryšys; π ryšys susidaro iš šoninio p orbitalių persidengimo, elektronų tankis — virš ir po anglų junginio plokštuma.
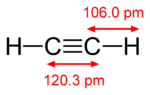
- Acetilenas (C2H2): trigubas ryšys — viena σ ir dvi π sąveikos (dvi tarpusavyje statmenos π orbitalės).
- Benzenas (C6H6): aromatinė delokalizuota π sistema, kur π elektronai yra paskirstyti per visą ciklą ir suteikia papildomos stabilumo energijos.
- Alilinis ir konjuguoti jonai: π delokalizacija paaiškina šių junginių stabilumą bei reaktivity patterns (pvz., allyl cation stabilizacija).
π ryšiai pereinamųjų metalų chemijoje
Pereinamųjų metalų kompleksuose pi sąveikos pasireiškia įvairiais būdais. Pavyzdžiui, ligandai gali perduoti π elektronus metalui arba metalas gali atgaliai perduoti elektronus į ligando π* orbitales (π-backbonding). Tai svarbu aprašant kompleksus su CO, alkenais ar alkilidinais, ir turi įtakos spektroskopinėms savybėms bei reaktyvumui.
Praktinė reikšmė
Pi ryšiai lemia daugelį organinės ir bioorganinės chemijos savybių: reaktyvumą elektrofilinėse ir radikalinėse reakcijose, UV–Vis absorbcijas, molekulių geometriją (planariškumą, rotacijos apribojimus) bei medžiagų optines ir elektronines charakteristikas (pvz., puslaidininkinių organinių junginių konjugacija). Pi elektronai taip pat svarbūs katalizėje, polimerų savybėse ir biologinėse molekulėse (pvz., pigmentuose ir porfirinuose).
Apibendrinant: π ryšiai yra šoninio p orbitalių persidengimo rezultatas, suteikiantis papildomą junginio stiprumą, trumpesnį tarpatominį atstumą ir specifines elektronines savybes — ypač svarbūs daugelyje organinių ir pereinamųjų metalų junginių.
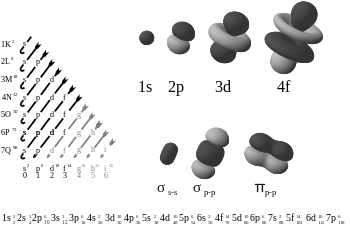
Elektroninės atominės ir molekulinės orbitalės, paveikslėlio apačioje dešinėje parodytas pi ryšys.

Dvi p orbitalės, sudarančios π ryšį.
Keli ryšiai
Atomai, sujungti dviguba jungtimi, turi vieną sigma jungtį ir vieną pi jungtį. Jei juos jungia triguboji jungtis, jie turi vieną sigma jungtį ir dvi pi jungtis.
Pi ryšys yra silpnesnis už sigma ryšį, tačiau pi ir sigma ryšių derinys yra stipresnis už bet kurį iš jų atskirai. Kelių ryšių stiprumas, palyginti su vienu (sigma ryšiu), pasireiškia įvairiais būdais. Akivaizdžiausias iš jų yra ryšio ilgio sumažėjimas. Pavyzdžiui, organinėje chemijoje anglies ir anglies jungčių ilgiai yra etane (154 pm), etilene (134 pm) ir acetilene (120 pm). Dėl didesnio skaičiaus ryšių bendras ryšys tampa trumpesnis ir stipresnis. Elektroninė konfigūracija pagrįsta S, P, D ir f blokais. S turi 2 elektronus P turi 6 elektronus D turi 10 elektronų F turi 14 elektronų
|
|
|
|
| etanas | acetilenas |
Specialūs atvejai
Pi ryšiai nebūtinai jungia atomų poras, kurios taip pat yra su sigma ryšiais.
Tam tikruose metalų kompleksuose pi sąveika tarp metalo atomo ir alkino bei alkeno pi antibondingo orbitalės sudaro pi ryšius.
Kai kuriais atvejais, kai tarp dviejų atomų yra daugybiniai ryšiai, sigma ryšio iš viso nėra, yra tik pi ryšiai. Pavyzdžiui, diirono heksakarbonilas (Fe2(CO) 6), dikarbonilas (C 2) ir boranas B 2H 2. Šiuose junginiuose centrinis ryšys turi tik pi ryšį. Kad orbitalės kuo labiau sutaptų, ryšių atstumai yra daug mažesni nei tikėtasi.
Klausimai ir atsakymai
K: Kas chemijoje yra pi ryšys?
Atsakymas: Pi ryšys - tai kovalentinis cheminis ryšys, kai vieno elektrono orbitinis kelias susikerta su kito elektrono orbitiniu keliu ir susidaro dvi persidengimo sritys, nes abiejų elektronų keliai sutampa.
K: Kokia graikiška raidė minima jų pavadinime?
A: Graikiška raidė, kuri yra jų pavadinime, yra π ir reiškia p orbitales.
K: Kokia yra pi ryšio orbitalės simetrija?
Atsakymas: Pi ryšio orbitalinė simetrija, žiūrint išilgai ryšio ašies, atrodo taip pat kaip p orbitalės, nes p orbitalės paprastai turi tokį ryšį.
K: Kodėl pi ryšiai paprastai yra silpnesni už sigma ryšius?
A: Pi ryšiai paprastai yra silpnesni už sigma ryšius, nes pagal kvantinę mechaniką orbitalės keliai yra lygiagretūs, todėl p orbitalės daug mažiau persidengia.
K: Kada atsiranda pi ryšiai?
A: Pi ryšiai susidaro, kai dvi atomo orbitalės liečiasi per dvi persidengimo sritis.
K: Kas yra pi ryšiai?
A: Pi ryšiai yra labiau išsidėstę ryšiai nei sigma ryšiai.
K: Ar pi ryšiu sujungti molekulės fragmentai gali suktis apie tą ryšį nepažeisdami pi ryšio?
Atsakymas: Ne, pi ryšiu sujungti molekuliniai fragmentai negali suktis apie tą ryšį nepažeisdami pi ryšio, nes sukimasis sunaikina dviejų p orbitalių lygiagrečius kelius.
Ieškoti