Alkinai (acetilenai): formulė, struktūra, savybės ir reakcijos
Alkinai (acetilenai): formulė, struktūra, cheminės savybės ir pagrindinės reakcijos — reaktyvumas, redukcija, adityvinės ir periciklinės transformacijos.
Alkinas yra molekulė, turinti trigubą ryšį tarp dviejų anglies atomų. Trigubą ryšį sudaro vienas σ- ir du π-jungtys, todėl anglies atomai trigubame ryšyje yra sp hibridizuoti ir grandinė prie jų yra linijinė (bondo kampas ~180°). Bendroji alkinų formulė yra CnH2n-2. Mažiausias alkinas yra acetilenas (etinas). Alkinai yra hidrofobiški: jie gerai tirpsta organiniuose tirpikliuose, bet prastai tirpsta vandenyje. Lengvi alkinai dažnai yra bespalviai dujiniai arba mažai klampūs skysčiai, juos gali lydėti aštrus kvapas ir jie yra degūs.
Formulė, nomenklatūra ir struktūra
Alkinai žymimi priesaga „-ynas“ (pvz., etinas/acetilenas, propinas). Trigubo ryšio padėtis žymima skaičiumi (pvz., 1-butinas – terminalinis, 2-butinas – vidinis). Struktūriškai alkinai gali būti terminaliniai (H–C≡C–R) arba vidiniai (R–C≡C–R'). Terminalių alkinų C–H ryšys yra specifinis (terminalioji acetyleno protono rūgštis).
Fizikinės savybės
- Nonpoliniai, dažniausiai netirpūs vandenyje.
- Mažesni alkinai (pvz., etinas, propinas) yra dujos; ilgesni – skysčiai arba kietos medžiagos.
- Terminalių alkinų C–H vibracija matoma IR spektre ~3300 cm−1 (aštrus ruožas); C≡C ruožas – apie 2100–2260 cm−1.
- Terminalaus alkinų protono cheminis poslinkis 1H NMR dažniausiai ~2–3 ppm; sp hibridizuoti angliai 13C NMR ~70–90 ppm.
Cheminės savybės ir dažniausios reakcijos
Alkinai yra reaktyvesni už paprastus angliavandenilius ir daugeliu atvejų reaguoja aktyviau nei alkenai, nes π-jungtys lengviau dalyvauja adityvinėse reakcijose. Jei alkinas yra molekulės gale, protoną (terminalų C–H) galima pakankamai lengvai pašalinti stipria baze (pavyzdžiui, NaNH2 ar n‑BuLi), susidarant acetilidiniam anijonui, kurį galima panaudoti kaip nukleofilą alkilinimo ar ataka prieš karbonilus.
- Deprotonacija ir alkilinimas: terminalius alkinus deprotonuojant su NaNH2 arba n‑BuLi, gaunamas acetilidinis anijonas, kuris atakuoja alkilhalogenidus (SN2) ir taip praplečia angliavandenilio grandinę.
- Adicija prie karbonilių: acetilidiniai anijonai reaguoja su ketonais ar aldehidais, duodami propargilinius alkoholus.
- Hidrogenavimas: visiškas hidrogenavimas su H2/Pd katalizatoriumi virsta alkanais; selektyvus iki cis-alkenų atliekamas su Lindlar katalizatoriumi (Pd su modifikatoriais), o iki trans-alkenų – tirpinto metalo redukcija (Na/NH3, skystas amoniakas).
- Halogenacija ir hidrohalogenacija: H–X adicija sukuria vinilinius halogenidus (vienkartinė adicija), o perteklius gali vesti prie geminalinių dihalogenidų; halogenai (Br2, Cl2) dažnai veda prie di‑ arba tetrabromidų/skirtingų papildomų produktų priklausomai nuo sąlygų.
- Hidracija: įprasta acidinė hidracija (HgSO4/H2O/H2SO4) terminalius alkinus paverčia į ketonus (tautomerizacija iš enolio į ketoną). Hidroboravimo‑oksidacijos (1) BH3 — 2) H2O2/OH−) terminalius alkinus paverčia aldehidais (anti‑Markovnikov regiochemija).
- Oksidacinis skilimas: stiprūs oksidantai (KMnO4, O3) suskaido alkinus iki atitinkamų karboksilinių rūgščių; terminalus alkinas gali oksiduotis iki CO2 ir rūgšties.
- Periciklinės ir ciklinės reakcijos: alkinai dalyvauja metalinis‑katalizuotose ciklotromerizacijose ([2+2+2] cikloaddicija) ir kituose pericikliniuose procesuose, kurių metu susidaro aromatiniai arba heterocikliniai junginiai.
Specifinės praktinės reakcijos ir pavyzdžiai
- Terminalaus alkinio deprotonacija: H–C≡C–R + NaNH2 → Na+–C≡C–R + NH3.
- Alkilinimas: Na+–C≡C–R + R'–X → R–C≡C–R' + NaX (SN2, su priminiais alkilhalogenidais).
- Hidrogenavimas iki cis‑alkeno: R–C≡C–R' + H2 (Lindlar) → R–CH=CH–R' (cis).
- Hidracija terminalio alkinui (hydroboration‑oxidation): R–C≡CH → R–CHO (aldehidas).
Sintezė ir panaudojimas
Alkinai sintezuojami įvairiais būdais: dehidrohalogenacija vinių halogenidų, alkilinimas acetilidiniais anjonais, alkenų dehidrogenizacija ir kt. Technologinėje praktikoje acetilenas (etinas) naudojamas kaip žaliava organinei sintezei, metalo suvirinimui (degančioji liepsna su deguonimi – „oxy‑acetylene“), polimerų ir cheminių reagentų gamyboje. Organinėse sintezėse alkinai yra vertingi kaip funkcionalių fragmentų įterpimo tarpininkai ir kaip dienofilai ar kontaktiniai komponentai kataliziniuose ciklinimo procesuose.
Saugos pastabos
Žemesnio molekulinio svorio alkinai, ypač acetilenas, gali būti sprogūs dujinėje fazėje ir reikalauja tinkamo saugojimo bei tvarkymo. Reakcijos su stipriomis bazėmis ar oksidantais turi būti atliekamos saugiai, laikantis tinkamų inercinių arba šalto darbo sąlygų.
Apibendrinant: alkinai (acetilenai) yra svarbi angliavandenilių klasė su unikalia triguba jungtimi, kuri lemia jų geometriją, cheminį aktyvumą ir plačias panaudojimo galimybes sintetinėje chemijoje.
Struktūra
Alkinai turi 180 laipsnių kampą tarp dviejų anglies atomų. Dėl šios priežasties jie nemėgsta būti cikliniuose junginiuose. Toliau pateikiami keli alkinų pavyzdžiai.
| · v · t · e Funkcinės grupės |
|
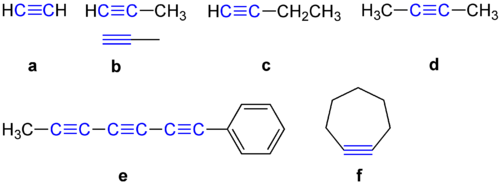
Alkinų pavyzdžiai
Klausimai ir atsakymai
K: Kas yra alkinas?
A: Alkinas yra molekulė, turinti trigubą ryšį tarp dviejų anglies atomų.
K: Kokia yra bendroji alkinų formulė?
A: Bendroji alkinų formulė yra CnH2n-2.
K: Koks yra mažiausias alkinas?
A: Mažiausias alkinas yra acetilenas, dar vadinamas etinu.
K: Ar alkinai yra hidrofobiniai, ar hidrofiliniai?
A: Alkinai yra hidrofobiniai, t. y. jie gerai tirpsta organiniuose tirpikliuose, bet ne vandenyje.
K: Kuo skiriasi kiekvienas iš eilės alkino narys?
A: Kiekvienas iš eilės alkino narys skiriasi savo molekuline forma su "-CH2".
K: Ar alkinai yra reaktyvesni už įprastus angliavandenilius?
A: Taip, alkinai daugelyje reakcijų yra reaktyvesni už įprastus angliavandenilius, pavyzdžiui, alkenus.
K: Ką galima daryti su alkinu, esančiu molekulės gale?
A: Jei alkinas yra molekulės gale, jį galima lengvai pašalinti protonuojant stipria baze ir panaudoti adityvinėse reakcijose, pavyzdžiui, pridedant prie ketono.
Ieškoti