Karbenas - reaktyvi anglies molekulė: singletas ir tripletas
Karbenas — reaktyvi anglies molekulė: singletas ir tripletas, elektroninė struktūra, reakcijos (adicijos, cheletropinės), stabilumas ir pavyzdys — Grubso katalizatorius.
Karbenas - tai molekulė, kurios anglies atomas turi du ryšius ir du kitus elektronus, kurie nesudaro jokių ryšių. Kadangi aplink anglį yra tik 6 elektronai, ji yra gana reaktyvi. Bendrąją formulę galima užrašyti taip: R-(C:)-R'.
Singletas ir tripletas
Karbenas gali būti singletas arba tripletas. Pirmojo tipo karbeno du elektronai, nesudarantys ryšių, yra tarsi vienišos poros. Jie abu lieka toje pačioje orbitalėje. Tripleto karbeno atveju abu elektronai būna skirtingose orbitalėse. Čia jie abu turi tą patį sukinį.
Trumpai: singletas — elektronų pora vienoje orbitalėje, dažnai sp2 hibridizacija su tuščia p orbitalė; tokie karbenai paprastai yra elektrofilai ir dalyvauja sutelktose (koncertuotose) reakcijose (pvz., tiesioginė ciklopropanacija). tripletas — du neporuoti elektronai skirtingose orbitalėse (diradikalinis pobūdis), todėl reakcijos dažnai vyksta žingsniais per radikalinius tarpininkus. Singleto ir tripleto energetinis skirtumas (singletas–tripletas tarpai) priklauso nuo substituentų ir aplinkos.
Kaip susidaro karbenai
- Alpha-eliminacija (pvz., iš halogenintų junginių reaguojant su bazėmis) — taip gaunamas, pavyzdžiui, dichlorocarbene (:CCl2) iš chloroformo.
- Terminė arba fotocheminė diazokomponentų suskaidymas (pvz., diazometanas suteikia :CH2) — dažnas laboratorinis metodas;
- Failingas ar metalu katalizuotas dekompozicija (metalo-katalizės atveju susidaro arba „laisvas“ karbenas, arba karbeno atitikmuo prie metalo — karbenoidas);
- Fotolizė ar plazminės/matrix-isolation sąlygos leidžia užfiksuoti trumpalaikius karbenus tyrimams.
Reakcijos ir taikymai
Karbenai gali atlikti daugybę reakcijų. Jie gali būti ir elektrofilai, ir nukleofilai. Jie mėgsta atlikti dvigubų ryšių adicijos reakcijas. Jie taip pat būna cheletropinėse reakcijose.
Dažni reakcijų tipai:
- Ciklopropanacija (pridėjimas prie alkenų) — svarbi sintetinė priemonė, ciklopropanų gamybai;
- Įterpimas (insertion) į C–H, O–H ar N–H ryšius;
- Ylidų ar karbeno komplekso formavimas su heteroatomais;
- Radikalinės reakcijos tripletų atveju: vandenilio atiminimas, radikaliniai prisijungimai;
- Cheletropinės reakcijos, kai C atomas įžengia į aromatinius arba konjuguotus sistemas.
Be praktinės sintetinės reikšmės (pvz., ciklopropanacijos, homologacijų, organometalinių reakcijų), karbenai yra svarbūs ir mechanistiniu požiūriu — jų elgsena (singletas vs tripletas) lemia reakcijų kelią ir stereochemiją.
Stabilumas ir metaliniai karbenai
Dauguma karbenų yra labai nestabilūs. Tačiau kai kurie jų gali egzistuoti ilgą laiką. Stabilumą didina:
- konjugacija ir rezonansinė delokalizacija (pvz., arilo substituentai);
- elektroninius efektus turintys substituentai, kurie užpildo tuščią p orbitalę arba stabilizuoja lone pair;
- stereocheminis apsaugumas (steriniai užtvarai);
- kompleksacija su metalais (susidarant metalo–karbeno ryšiui).
Garsus pavyzdys yra Grubso katalizatorius, kurį sukūrė Robertas Grubbsas. Tai organometalinis kompleksas, turintis metalo–karbeno (alkilideno) ryšį, plačiai naudojamas olefinų metatezės reakcijose. Tokie metalo karbenai yra daug stabilesni už „laisvus“ karbenus ir turi specifinę elektroninę charakteristiką: skiriami, pavyzdžiui, Fischer ir Schrock tipo karbenai pagal metalo oksidacijos būseną ir elektroninę prigimtį (vieni būna labiau elektrofiliniai, kiti — labiau nukleofiliniai).
Stebėjimas ir praktinės pastabos
Trumpalaikius karbenus tiria UV–Vis spektroskopija, EPR (ypač tripletams), matrix-isolation eksperimentai ir greitos trukmės kinetikos metodai. Daug karbenų tyrimų grindžiami jų sugaudymo (trapping) eksperimentais — leidžiant karbenui reaguoti su medžiaga, kurios produkto prigimtis atskleidžia karbeno pobūdį.
Apibendrinant: karbenai yra svarbūs ir įdomūs tarpininkai organinėje ir organometalinėje chemijoje. Jų dvikryptė elgsena (elektrofilinė arba radikalinė/nukleofilinė), singletų ir tripletų skirtumai bei galimybė stabilizuotis per substituentus ar metalų kompleksus daro juos universaliais įrankiais sintetinėje chemijoje ir mechanistiniuose tyrimuose.
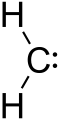
Karbenas
Klausimai ir atsakymai
K: Kas yra karbenas?
A: Karbenas yra molekulė, kurioje anglies atomas turi du ryšius ir du kitus elektronus, kurie nesudaro jokių ryšių.
K: Kodėl karbenas yra reaktyvus?
A: Karbeno anglis turi tik 6 elektronus, todėl yra gana reaktyvi.
K: Kokia yra bendroji karbeno formulė?
A: Bendroji karbeno formulė gali būti užrašyta taip: R-(C:)-R'.
K: Kokie yra du karbeno tipai?
A: Karbenai yra dviejų tipų: singletinis ir tripletinis.
K: Kuo skiriasi singletinis ir tripletinis karbenas?
A: Singletiniame karbene du elektronai, kurie nesudaro ryšių, yra tarsi vienišos poros ir lieka toje pačioje orbitalėje. Tripletiniame karbene du elektronai yra skirtingose orbitalėse ir turi tą patį sukinį.
K: Kokias reakcijas gali atlikti karbenai?
A: Karbenai gali atlikti daugybę reakcijų. Jie gali būti ir elektrofilai, ir nukleofilai, ir mėgsta atlikti dvigubų ryšių adicijos reakcijas. Jie taip pat dalyvauja cheletropinėse reakcijose.
K: Ar karbenai yra stabilūs?
A: Dauguma karbenų yra labai nestabilūs, tačiau kai kurie gali egzistuoti ilgą laiką. Pavyzdžiui, Grubso katalizatorius, kurį sukūrė Robertas Grubbsas.
Ieškoti