Cheletropinės reakcijos: apibrėžimas, mechanizmas ir pavyzdžiai
Cheletropinės reakcijos: išsamus apibrėžimas, periciklinis mechanizmas, orbitalių pertvarka, cheletropinės ekstruzijos ir aiškūs pavyzdžiai suprantamai paaiškinti.
Cheletropinės reakcijos - tai periciklinės reakcijos rūšis, kai vieno iš reagentų atomas įgauna du naujus ryšius. Periciklinė reakcija yra tokia, kai pereinamoji būsena apima ciklinę atomų aibę ir su ja susijusią ciklinę sąveikaujančių orbitalių aibę. Šiame cikliniame masyve vyksta σ ir π ryšių pertvarkymas.
Apibrėžimas ir pagrindinės savybės
Cheletropinės reakcijos yra cikloadjunkcijos poklasis. Joms būdinga, kad viename iš reagentų abu nauji ryšiai sudaromi su tuo pačiu atomu arba atvirkščiai – du ryšiai iš karto nutrūksta tame pačiame atome. Tai atskiria cheletropines reakcijas nuo įprastų cikloadjunkcijų, kur nauji ryšiai susidaro tarp skirtingų atomų. Reakcija gali vykti tiek kaip cheletropinė adicija (maža molekulė prijungiama prie daugiauženkliu junginio), tiek kaip cheletropinė ekstruzija (išmetama maža, stabili molekulė).
Mechanizmas ir orbitalinė simetrija
Cheletropinės reakcijos dažniausiai yra koncertinės (vieno žingsnio) periciklinės reakcijos, kurių pereinamojoje būsenoje dalyvauja uždaras orbitalių ratas. Woodward–Hoffmann taisyklės (konservacija orbitalių simetrijos) lemia, ar konkreti cheletropinė reakcija yra leidžiama termo- arba fotoindukuotomis sąlygomis. Svarbus aspektas yra tai, ar mažas reagentas – pvz., SO2 arba karbenas – reaguoja suprafacial ar antarafacial būdu santykyje su π-sistemos orbitalėmis.
Singletiniai ir tripletiniai karbenai: dauguma cheletropinių adicijų su karbenais vyksta singletinių karbenų atveju kaip koncertinės reakcijos, o tripletiniai karbenai dažnai reaguoja per laisvųjų radikalų tarpininkus (žingsniškai), todėl stereochemija ir kinetika skiriasi.
Pavyzdžiai
- SO2 + 1,3-butadienas → sulfolenas: tai klasikinis cheletropinės adicijos pavyzdys, kurio metu sieros atomas SO2 užmezga du ryšius su butadieno galais ir susidaro ciklinis sulfono darinys (sulfolenas). Reakcija reversyvi – sulfolenas termiškai gali išskirti SO2 (cheletropinė ekstruzija), atkurdamas butadieną.
- Karbenų adicija prie alkenų: singletiniai karbenai (pvz., dichlorokarbenas) prijungia karbeno anglies atomą prie dvigubo ryšio, sudarydami ciklopropano žiedą. Abu nauji ryšiai formuojami prie to pačio karbeno atomo, todėl tai laikoma cheletropine adicija.
- Cheletropinės ekstruzijos: termiškai arba fotochemiškai vykstančiose reakcijose gali išsiskirti maži stabilūs dujiniai produktai, tokie kaip CO arba N2, kas suteikia didelį entropinį postūmį reakcijai. Pavyzdžiui, daug organinių perėjimų ir terminio skaidymo reakcijų pasižymi CO arba N2 išsiskyrimu kaip varomąja jėga.
Termodinaminiai ir kinetiniai veiksniai
Cheletropinių reakcijų vyksmą lemia keletas veiksnių:
- Orbitalinė sąveika: suderinamumas tarp dalyvaujančių orbitalių (π ir tinkamų σ arba n orbitalių) yra itin svarbus.
- Elektroniniai efektai: elektroną atitraukiančios ar donorinės grupės daugiaženklyje gali stabilizuoti arba destabilizuoti pereinamąją būseną.
- Temperatūra ir entropija: cheletropinės ekstruzijos, kuriomis išsiskiria dujos (pvz., CO arba N2), dažnai yra entropiškai skatinamos ir geriau vyksta aukštesnėje temperatūroje.
- Katalizatoriai ir terpė: Lewis rūgštys ar metaliniai katalizatoriai gali suaktyvinti tam tikras π-sistemas arba stabilizuoti perinamas būsenas, keičiant reakcijos greitį ir selektyvumą.
Stereochemija ir selektyvumas
Nors daug cheletropinių adicijų yra koncertinės ir todėl stereospecifiškos, galutinė stereochemija priklauso nuo reagentų pobūdžio (pvz., singlet vs triplet karbenas), reagento priėjimo kampo ir izoliuotų tarpininkų nebuvimo. Woodward–Hoffmann principai leidžia prognozuoti, ar tam tikra konfigūracija yra orbitalių požiūriu leidžiama termiškai ar fotochemškai.
Praktinė reikšmė
Cheletropinės reakcijos yra vertingos sintezės chemijoje:
- jos leidžia efektyviai įvesti mažus heteroatomų vienetus (pvz., SO2, karbenai) į didesnius karkasus,
- ekstruzijos reakcijos naudojamos kaip būdas generuoti reaguojančias tarpinės būsenas arba išlaisvinti dujas, kurios paskatina tolimesnes transformacijas,
- supratimas apie orbitalinę simetriją padeda projektuoti selektyvias ir stereospecifines sintezes.
Santrauka: cheletropinės reakcijos yra specialus periciklinių procesų atvejis, kuriuose vienas atomas sudaro arba nutraukia du ryšius tuo pačiu metu. Jos gali vykti kaip adicijos arba ekstruzijos ir jų eiga stipriai priklauso nuo orbitalių simetrijos, reagentų tipo (pvz., singlet/triplet karbenai) bei termodinamikos ir kinetikos veiksnių. Daug praktinių sintezės problemų sprendžiamos pasitelkiant cheletropines transformacijas.

1 pav. Periciklinės reakcijos
Teorinė analizė
Dėl cheletropinėse reakcijose dalyvaujančių molekulių geometrijos jos patvirtina daugelį chemikų teoretikų prognozių. Cheletropinės reakcijos patvirtina molekulinių orbitų simetrijos išsaugojimą.
Periciklinėje pereinamojoje būsenoje maža molekulė atiduoda du elektronus žiedui. Reakciją galima paaiškinti dviem galimomis geometrijomis. Mažoji molekulė gali artėti linijiniu arba nelinijiniu būdu. Linijinio priartėjimo atveju mažosios molekulės orbitalės elektronai nukreipti tiesiai į didžiosios molekulės π sistemą. Nelinijinio priartėjimo atveju orbitalės artėja šiek tiek nuokrypiu. Mažajai molekulei artėjant prie jos, π sistemos gebėjimas suktis yra labai svarbus sudarant naujus ryšius. Sukimosi kryptis skirsis priklausomai nuo to, kiek π elektronų yra sistemoje. Toliau pateikta dviejų elektronų fragmento, artėjančio prie keturių elektronų π-sistemos, naudojant ribines molekulines orbitales, schema. Sukimasis bus disrotacinis, jei maža molekulė artėja tiesiškai, ir konrotacinis, jei molekulė artėja netiesiškai. Disrotacinis ir konrotacinis pasisukimas rodo, kaip sukasi π sistemos ryšiai. Disrotacija reiškia priešingas kryptis, o konrotacija - tą pačią kryptį. Tai taip pat parodyta toliau pateiktoje diagramoje.
Pagal Huckelio taisyklę galima nustatyti, ar π sistema yra aromatinė, ar antiaromatinė. Jei ji yra aromatinė, taikant tiesinį metodą naudojamas disrotacinis judesys, o taikant netiesinį metodą - konrotacinis judesys. Priešingai yra, jei sistema yra antiaromatinė. Linijiniu būdu bus naudojamas konrotacinis judesys, o netiesiniu - disrotacinis judesys.
Cheletropinės reakcijos, kuriose dalyvauja SO2
Termodinamika
Sieros dioksidui reaguojant su butadieniu ir izoprenu, susidaro du skirtingi produktai. Nuo reakcijos mechanizmo priklauso, kas susidarys. Galimas ir kinetinis, ir termodinaminis produktas. Termodinaminio produkto susidaro daugiau nei kinetinio. Kinetinis produktas susidaro vykstant Dielso-Alderio reakcijai, o vykstant cheletropinei reakcijai susidaro termodinamiškai stabilesnis produktas. Cheletropinis kelias naudojamas dažniau, nes jo metu susidaro stabilesnis penkių narių žiedo aduktas. Toliau pateiktoje schemoje parodytas dviejų produktų skirtumas. Kairėje pusėje pavaizduotas termodinaminis produktas, o dešinėje - kinetinis produktas. Suarezas ir Sordo tai parodė 1995 m. Jie tai įrodė ir eksperimentuodami, ir naudodami Gauso skaičiavimus.
Kinetika
Vienas iš pavyzdžių - 1,3-dienų cheletropinės reakcijos su sieros dioksidu. Chemikai atidžiai išnagrinėjo šios reakcijos kinetiką. 1976 m. Isaacsas ir Laila išmatavo sieros dioksido pridėjimo prie butadieno darinių kenetikos koeficientus. Papildymo greičiai buvo stebimi benzene 30 °C temperatūroje, esant pradiniam dvidešimt kartų didesniam dieno pertekliui. SO2 išnykimui matuoti jie naudojo spektrofotometrą, kuriuo buvo tiriama 320 nm šviesa. Reakcija pasižymėjo "pseudo pirmosios eilės kinetika". Chemikai nustatė, kad elektronus atimančios dieno grupės sumažino reakcijos greitį. Be to, reakcijos greičiui didelę įtaką darė 2-substituentų sterinis poveikis, o stambesnės grupės didino reakcijos greitį. (Kitaip tariant, kuo didesnė nuo antrojo anglies atomo kabanti atomų grupė, tuo reakcija vyko greičiau). Autoriai tai aiškina didelių gabaritų grupių polinkiu palaikyti cisoidinę dieno konformaciją, kuri yra būtina reakcijai (žr. lentelę toliau). Be to, septyniems dienams buvo išmatuoti keturių temperatūrų greičiai. Remdamiesi šiais matavimais, chemikai pagal Arrenijaus lygtį apskaičiavo kiekvienos reakcijos aktyvavimo entalpiją (ΔH‡) ir aktyvavimo entropiją (ΔS‡). Tai buvo vienas pirmųjų svarbių bandymų ištirti cheletropinės reakcijos kenetiką.
| -butadienas | 104 k /min−1 (30 °C) (± 1-2 %) absoliutus | 104 k /min−1 (30 °C) (± 1-2 %) santykinis | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-metilo | 1.83 | 1.00 | 14.9 | -15 |
| 2-etil | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropilas | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butilo | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentilas | 17.2 | 9.4 | 11.6 | -18 |
| 2-kloro | 0.24 | 0.13 | NETAIKOMA | NETAIKOMA |
| 2-bromoetil | 0.72 | 0.39 | NETAIKOMA | NETAIKOMA |
| 2-p-toilas | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenilas | 17.3 | 9.45 | NETAIKOMA | NETAIKOMA |
| 2-(p-bromfenil) | 9.07 | 4.96 | NETAIKOMA | NETAIKOMA |
| 2,3-dimetilo | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metil | 0.18 | 0.10 | NETAIKOMA | NETAIKOMA |
| trans-1-metil | 0.69 | 0.38 | NETAIKOMA | NETAIKOMA |
| 1,2-dimetileno-cikloheksanas | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,1,4,4-d4 | 1.96 | NETAIKOMA | NETAIKOMA | NETAIKOMA |
Monnat, Vogel ir Sordo 2002 m. išmatavo sieros dioksido pridėjimo prie 1,2-dimetilidendecikloalkanų kinetiką. Jie rašė, kad 1,2-dimetilidenecikloheksano reakcija su sieros dioksidu gali duoti du skirtingus produktus, priklausomai nuo reakcijos sąlygų. Kinetiniu būdu (≤ -60 °C) vykstant hetero-Dielso-Alderio reakcijai susidaro atitinkamas sultinas, o termodinaminiu būdu (≥ -40 °C) vykstant cheletropinei reakcijai susidaro atitinkamas sulfolenas. Hetero-Dielso-Alderio reakcijos aktyvavimo entalpija yra maždaug 2 kcal/mol mažesnė už atitinkamos cheletropinės reakcijos aktyvavimo entalpiją. Sulfolenas yra apie 10 kcal/mol stabilesnis už izometrinį sultiną CHCl/SO222 tirpale.
Autoriams pavyko eksperimentiškai nustatyti 1,2-dimetilidenecikloheksano reakcijos su sieros dioksidu, kai gaunamas atitinkamas sulfolenas, greičio dėsnį 261,2 K temperatūroje. Reakcija buvo pirmos eilės su 1,2-dimetilidenecikloheksanu, bet antros eilės su sieros dioksidu (žr. toliau). Tai patvirtino chemikų teoretikų prognozę, pagrįstą aukšto lygio ab initio kvantiniais skaičiavimais. Taikydami skaičiavimo metodus, autoriai pasiūlė 1,2-dimetilidenecikloheksano cheletropinės reakcijos su sieros dioksidu pereinamąją struktūrą (žr. paveikslėlį dešinėje). Reakcija yra antros eilės pagal sieros dioksidą, nes kita sieros dioksido molekulė greičiausiai prisijungia prie pereinamosios būsenos ir padeda ją stabilizuoti. Panašūs rezultatai gauti ir 1995 m. Suarezo, Sordo ir Sordo atliktame tyrime, kuriame, naudojant ab initio skaičiavimus, buvo tiriama sieros dioksido reakcijos su 1,3-dieniais kinetinė ir termodinaminė kontrolė.
d [ ]3 d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Tirpiklio poveikis
Cheletropinės 3,4-dimetil-2,5-dihidrotiofen-1,1-dioksido reakcijos (parodyta dešinėje) tirpiklio poveikis buvo kinetiškai ištirtas 14 tirpiklių. Nustatyta, kad tiesioginės ir atvirkštinės reakcijos reakcijos greičio konstantos ir pusiausvyros konstantos tiesiškai koreliuoja su tirpiklio poliškumo skale ET(30).
Reakcijos vyko 120 °C temperatūroje ir buvo tiriamos atliekant reakcijos mišinio 1H-NMR spektroskopiją. Nustatyta, kad tiesioginis greitis k1, pereinant nuo cikloheksano prie metanolio, sumažėjo 4,5 karto. Nustatyta, kad atvirkštinis greitis k-1 nuo cikloheksano iki metanolio padidėjo 53 kartus, o pusiausvyros konstanta Keq sumažėjo 140 kartų. Daroma prielaida, kad aktyvacijos proceso metu keičiasi poliškumas, kaip rodo pusiausvyros ir kinetinių duomenų ryšiai. Autoriai teigia, kad reakcijai, atrodo, daro įtaką tirpiklio poliškumas, ir tai galima įrodyti dipolinių momentų pokyčiu pereinant nuo reagento prie pereinamosios būsenos ir produkto. Autoriai taip pat teigia, kad cheletropinei reakcijai neatrodo, jog įtakos turėtų tirpiklio rūgštingumas ar baziškumas.
Šio tyrimo rezultatai leidžia autoriams tikėtis tokio elgesio:
1. Tirpiklio poliškumo pokytis turės mažesnę įtaką greičiui nei pusiausvyra.
2. Greičio konstantoms bus būdingas priešingas poliškumo poveikis: k1 šiek tiek sumažės didėjant ET(30), o k-1 padidės tomis pačiomis sąlygomis.
3. Poveikis k-1 bus didesnis nei k1.

1,2-dimetilidendecikloheksano reakcija su SO2, kurios metu gaunamas sulfinas, vykstant heterodilso-Alderio reakcijai, kontroliuojamai kinetiniu būdu, arba sulfolenas, vykstant cheletropinei reakcijai, kontroliuojamai termodinaminiu būdu

Siūloma pereinamoji būsena 1,2-dimetilidendecikloheksano reakcijai su SO2 siekiant gauti sulfoleną vykstant cheletropinei reakcijai
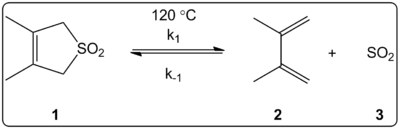
Cheletropinės reakcijos tyrimai įvairiuose tirpikliuose
Karbenų pridėjimas prie alkenų
Viena iš svarbiausių sintetiniu požiūriu cheletropinių reakcijų yra singletinio karbeno pridėjimas prie alkeno, kad susidarytų ciklopropanas (žr. paveikslėlį kairėje). Karbenas yra neutrali molekulė, turinti dvivalentę anglį su šešiais elektronais valentiniame apvalkale. Todėl karbenai yra labai reaktyvūs elektrofilai ir susidaro kaip tarpiniai reakcijos produktai. Singletiniame karbene yra tuščia p orbitalė ir apytiksliai sp 2hibridinė orbitalė, turinti du elektronus. Singletiniai karbenai stereospecifiškai prisijungia prie alkenų, o alkeno stereochemija išlieka ciklopropano produkte. Karbeno pridėjimo prie alkeno mechanizmas yra suderinta [2+1] cikloaplinka (žr. paveikslą). Iš chloroformo arba bromoformo gautus karbenus galima naudoti CX2 pridėjimui prie alkeno, kad gautųsi dihalociklopropanas, o Simmonso-Smito reagentas prideda CH2.
Užpildytos karbeno orbitalės sąveika su alkeno π sistema sukuria keturių elektronų sistemą ir sudaro palankias sąlygas netiesiniam metodui. Taip pat palanku maišyti tuščią karbeno p orbitalę su užpildyta alkenų π orbitalėmis. Palankus maišymas vyksta taikant netiesinį metodą (žr. 2 pav. dešinėje). Tačiau, nors teorija akivaizdžiai palankesnė netiesiniam metodui, nėra jokių akivaizdžių eksperimentinių pasekmių, susijusių su tiesiniu ar netiesiniu metodu.

Karbeno pridėjimas prie alkeno, kad susidarytų ciklopropanas

2 pav. A) Singletinių karbenų orbitalės B) Netiesinis a) karbeno sp2 orbitalės ir b) karbeno p orbitalės metodas
Klausimai ir atsakymai
K: Kas yra cheletropinė reakcija?
Atsakymas: Cheletropinė reakcija yra periciklinės reakcijos rūšis, kai vieno iš reagentų atomas įgauna du naujus ryšius.
K: Kas yra periciklinė reakcija?
Atsakymas: Periciklinė reakcija yra tokia reakcija, kuri apima pereinamąją būseną su cikliniu atomų masyvu ir susijusiu cikliniu sąveikaujančių orbitalių masyvu, kai vyksta َ ir ً ryšių pertvarkymas.
K: Kuo ji skiriasi nuo kitų tipų reakcijų?
Atsakymas: Cheletropinės reakcijos yra cikloadjunkcijų poklasis, o nuo kitų reakcijų tipų jos skiriasi tuo, kad viename iš reagentų abu nauji ryšiai sudaromi su tuo pačiu atomu.
K: Kokie yra keli pavyzdžiai?
Atsakymas: Pavyzdžiai yra "cheletropinės ekstruzijos", pavyzdžiui, kai vienas karbonilo grupės atomas atsiduria anglies monokside.
K: Kas skatina šias reakcijas?
A: Šių reakcijų varomoji jėga dažnai yra entropinė nauda, gaunama išlaisvinant dujas (pvz., CO arba N2).
K: Ar 1 pav. yra susijęs su cheletropinėmis reakcijomis? A: Taip, 1 paveiksle pateikti cheletropinių reakcijų pavyzdžiai.
Ieškoti
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)