Konrotacinės ir disrotacinės elektrociklinės reakcijos – apibrėžimas
Sužinokite konrotacinių ir disrotacinių elektrociklinių reakcijų apibrėžimą, Woodward–Hoffmann taisykles, orbitalinės simetrijos vaidmenį ir 4n/4n+2 π elektronų reikšmę.
Šiais terminais apibūdinamos dvi elektrociklinės reakcijos (organinių cheminių reakcijų rūšis) klasės. Konjuguotos dvigubos jungties sistemos galuose esantys pakaitalai žiedo atidarymo arba uždarymo metu juda ta pačia (pagal laikrodžio rodyklę arba prieš laikrodžio rodyklę) kryptimi — tai vadinama konrotacine (conrotatory) eiga. Disrotaciniu (disrotatory) režimu galinės grupės sukasi priešingomis kryptimis.
Kas lemia sukimosi kryptį?
Svarbiausias principas yra orbitinė simetrija ir aukščiausios užimtos molekulinės orbitalės (HOMO) fazių išlyginimas. Norint susidaryti sigma (σ) ryšiui tarp dviejų galinių p orbitų, tų orbitų fazės turi atitikti vienas kitą susijungimo vietoje. Sukimosi kryptis parenkama taip, kad šis fazių sutapimas būtų išsaugotas — kitaip reakcija yra nepageidaujama arba turi aukštesnę energiją.
Terminiai ir fotoindukuoti (fotocheminiai) persitvarkymai
Terminiu būdu vykstančios elektrociklinės reakcijos yra stereospecifinės ir jų eiga priklauso nuo konjuguotos sistemos pi elektronų skaičiaus:
- 4n + 2 pi elektronų (pvz., 6, 10, ...) — terminiu būdu vyrauja disrotacinė eiga;
- 4n pi elektronų (pvz., 4, 8, ...) — terminiu būdu vyrauja konrotacinė eiga.
Fotocheminiu (fotoindukuotu) persitvarkymu rolės apsiverčia: reakcijos, kurios terminiu būdu vyksta konrotaciniu būdu, fotoindukuotos dažnai vyksta disrotaciniu būdu ir atvirkščiai. Tai susiję su tuo, kad fotoizoliacija pakelia elektroną į aukštesnę orbitalę ir keičia orbitinių fazių išsidėstymą bei simetriją, todėl pasikeičia ir reikalingas sukimosi režimas.
Pavyzdžiai ir mechanistinė paaiška
Pavyzdžiui, trans-cis-trans-2,4,6-oktatrieno konversija į cis-dimetilcikloheksadieną (paveikslėlio viršuje) reikalauja disrotacinio režimo pagal orbitinę mechaniką: oktatrieno HOMO simetrija verčia galines π orbitales judėti priešingomis kryptimis, kad susidarytų teisinga simetrija, būdinga sigma ryšiui.

Kitas dažnai minimas pavyzdys — 1,3-butadieno (4 π elektronai, 4n) ciklinimas į ciklobuteną: terminiu būdu tai vyksta konrotaciškai, o apšvitinus ultravioletine šviesa — disrotaciškai. Tuo tarpu 1,3,5-hexatrienas (6 π elektronų, 4n + 2) terminiu būdu ciklinasi disrotaciškai į cikloheksadieną.
Stereospecifiškumas ir sintezės reikšmė
Elektrociklinės reakcijos yra stereospecifinės: pradinės alkenų (arba vadinamųjų terminalinių substitutų) konfigūracijos nustato, kurią stereochemiją turės produktas. Todėl toks tipus reakcijų plačiai naudojami organinėje sintezėje, kai reikia kontroliuoti stereochemiją be papildomų katalizatorių ar reagavimo etapų.
Apibendrinimas (Woodward–Hoffmann taisyklės)
Woodwardo-Hoffmanno taisyklės glaustai apibendrina aukščiau nurodytus principus: orbitinė simetrija lemia, kurios pericyklinės reakcijos yra termodinaminiu arba fotocheminiu keliu leidžiamos ar draudžiamos. Trumpai:
- Termiškai: 4n+2 → disrotaciniu; 4n → konrotaciniu.
- Fotochemiškai: taisyklė apsiverčia — 4n+2 → konrotaciniu; 4n → disrotaciniu.
Šios taisyklės ir orbitinė analizė padeda prognozuoti reakcijų stereochemiją bei parinkti tinkamas sąlygas norimam produktui gauti. Elektrociklinės reakcijos yra svarbus įrankis organinės chemijos sintezėje ir mechanistiniuose tyrimuose.
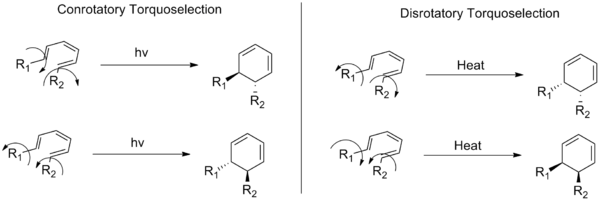
Konrotacinis ir disrotacinis sukimosi būdai, rodantys dvi galimas sukimosi kryptis, dėl kurių susidaro bendrosios heksatrienų sistemos enantiomerų poros.
Klausimai ir atsakymai
K: Kas yra elektrociklinė reakcija?
A. Elektrociklinė reakcija - tai organinė cheminė reakcija, kurios metu konjuguotų dvigubų ryšių sistema atsidaro arba užsidaro ir sudaro žiedą.
K: Kuo skiriasi konrotacinis ir disrotacinis režimai?
A.: Konrotacijos atveju, atsidarant arba užsidarant žiedui, konjuguotos dvigubos jungties sistemos galuose esantys substituentai juda ta pačia (pagal arba prieš laikrodžio rodyklę) kryptimi. Priešingai, disrotaciniu režimu jie juda priešingomis kryptimis.
Klausimas: Kokią įtaką šioms reakcijoms turi orbitinė simetrija?
A: Nustatant, ar reakcija vyksta pagal konrotacines, ar disrotacines taisykles, reikia atsižvelgti į reakcijos orbitinę mechaniką. Pavyzdžiui, sistemos, kuriose yra 4n + 2 pi elektronų, yra stereospecifinės ir joms taikoma konrotacinė taisyklė, nes jų aukščiausiai užimtose molekulinėse orbitalėse (HOMO) išlaikoma orbitinė simetrija. Sistemos, kuriose yra 4n pi elektronų, pasižymi priešingu disrotaciniu režimu. Tai taip pat pasakytina apie 4n + 2 pi (kur n yra sveikasis skaičius) elektronų pertvarkymus, kuriuos lemia šviesa (fotoindukuotus). Fotoindukuoti 4n pi elektronų sistemų (kai elektronų skaičius dalijasi iš 4) pertvarkymai vyksta pagal disrotacijos taisyklę.
K: Kas yra Vudvordo-Hofmano taisyklės?
A: Woodwardo-Hoffmanno taisyklės apibendrina skirtingus elektrociklinių reakcijų tipus ir tai, kokią įtaką jiems daro tokie veiksniai kaip orbitų simetrija ir šviesos energijos buvimas/nebuvimas.
K: Ką rodo šis paveikslėlis?
Atsakymas: Paveikslėlyje parodytas trans-cis-trans-2,4,6-oktatrieno virsmo į cis-dimetilcikloheksadieną pavyzdys ir parodyta, kaip substituentai juda skirtingai, priklausomai nuo to, ar tai yra konorotarinis, ar disrorotarinis režimas - atitinkamai pagal laikrodžio rodyklę ir prieš laikrodžio rodyklę, žiūrint iš viršaus.
Ieškoti