Termochemija – termodinamikos ir šilumos mokslas apie chemines reakcijas
Atraskite termochemiją: kaip termodinamika ir šiluma lemia chemines reakcijas — entalpija, entropija, energijos pokyčiai ir reakcijų palankumas.
Termochemija - tai mokslas apie energiją ir šilumą, susijusią su cheminėmis reakcijomis ir fizikiniais virsmai (fizikiniais pokyčiais). Fizikiniai virsmai vyksta tada, kai medžiagos būsena (pvz., kieta arba skysta) pasikeičia į kitą būseną. Fizikinių virsmų pavyzdžiai: lydymasis (kai kieta medžiaga virsta skysčiu) ir virimas (kai skystis virsta dujomis). Šiuose procesuose keičiantis tarpmolekuliniams ryšiams, prisijungia arba atsiskiria šiluminė energija; termochemija aiškinasi, kiek energijos reikia arba išsiskiria ir kaip šie pokyčiai priklauso nuo temperatūros ir slėgio.
Pagrindinės sąvokos
Termochemija remiasi termodinamikos principais, kad būtų galima kiekybiškai aprašyti energijos pokyčius. Svarbiausios sąvokos:
- Entalpija (H) – sistema atiduoda arba sugeria šilumą esant pastoviam slėgiui. Entalpijos pokytis ΔH apibūdina, ar reakcija išskiria, ar sugeria energiją. ΔH < 0 reiškia, kad reakcija yra egzoterminė (išskiria šilumą), o ΔH > 0 – endoterminė (sugeria šilumą).
- Entropija (S) – sistemos netvarkos arba dalelių išsidėstymo laisvės matas; didėjanti entropija paprastai palanki reakcijai vykti.
- Laisvoji energija (G) (Gibbs) – ΔG = ΔH − TΔS; ji nusako reakcijos savaiminio (spontaniškumo) linkį esant pastoviai temperatūrai ir slėgiui. Jei ΔG < 0, procesas yra termodinamiškai palankus (savaiminis).
- Šiluminė talpa – kiek energijos reikia, kad medžiagos temperatūra pakiltų vienu laipsniu.
- Degimo šiluma, susidarymo šiluma – specialūs entalpijų tipai, dažnai naudojami cheminės energetikos apskaičiavimuose.
- Kalorijos ir džauliai – energijos vienetai (1 cal ≈ 4,184 J).
Endo- ir egzoterminės reakcijos
Tekste yra tas teiginys: Vykstant endoterminėms reakcijoms, išsiskiria šiluma. Tačiau svarbu paaiškinti teisingai: endoterminės reakcijos išorėje sugeria šilumą (ΔH > 0), o egzoterminės reakcijos atiduoda šilumą (ΔH < 0). Kitaip tariant, egzoterminėms reakcijoms reikia pašalinti šilumą iš sistemos, kad aplinka sušiltų, o endoterminėms – tiekti šilumą iš aplinkos, kad sistema atšaltų ar įsisavintų energiją.
Kas lemia, ar reakcija įvyks?
Termochemijoje derinamos termodinamikos sąvokos su cheminių ryšių energijos idėja: suskaidant ir formuojant cheminius ryšius pasikeičia vidinė energija. Termodinaminiu požiūriu svarbiausi faktoriai yra:
- ΔH – entalpijos pokytis (energetinis „biudžetas“),
- ΔS – entropijos pokytis (sistemos išsidėstymo laisvė),
- T – temperatūra, kuri įtakoja ΔG pagal ryšį ΔG = ΔH − TΔS.
Termochemikai naudoja šiuos dydžius, kad nustatytų, ar procesas bus savaiminis ar nesavaiminis, palankus ar nepalankus, ir kaip temperatūra gali pakeisti reakcijos kryptį.
Matavimai, skaičiavimai ir įrankiai
Termochemijoje atliekami kalorimetrijos bandymai, kad matuoti išskiriamą arba įsisavinamą šilumą:
- Bombų kalorimetrai – matuoja degimo šilumą (naudojama standžiai uždarytiems degimo procesams);
- Kalorimetrai su variniu indeliu ir matavimais vandens temperatūros pakitimui;
- Skaičiavimai pagal Hess'o dėsnį – entalpijų pokytis nepriklauso nuo reakcijos eigos, tad galima sudėti žingsnius ir naudoti žinomų reakcijų entalpijas norint gauti sudėtingesnės reakcijos ΔH;
- Naudojant standartines susidarymo entalpijas ir lentelese pateiktus duomenis apskaičiuojamos entalpijos, entropijos ir laisvosios energijos reikšmės.
Tipiniai matavimo vienetai yra džauliai (J) arba kilodžauliai (kJ) vienai molinei medžiagos kiekiui. Termocheminiai skaičiavimai dažnai susiejami su prognozuojant reaguojančių medžiagų ir produktų kiekius tam tikru laiku bei vertinant, ar reakcija termodinamiškai palanki, net jei kinetiškai lėta.
Praktinė reikšmė ir taikymai
Termochemija turi platų pritaikymą:
- Energetika ir degimo procesai – įvertinti kuro energinę vertę (šiluminė talpa, degimo šiluma);
- Pramoninės cheminių procesų optimizavimas – energijos balansai ir aušinimo/šilumos tiekimo sprendimai;
- Medžiagų mokslo – faziniai perėjimai, lydosi ir garavimai priklauso nuo energetinių sąlygų;
- Biochemija ir metabolizmas – cheminės reakcijos gyvuose organizmuose taip pat turi entalpinius ir entropinius aspektus;
- Aplinkos analizė – pvz., šiluminiai pokyčiai chemijos reakcijose atmosferoje ar dirvožemyje.
Trumpas apibendrinimas
Termochemija jungia termodinamikos principus su cheminėmis žiniomis, kad nustatytų, kiek energijos yra susiję su cheminėmis reakcijomis ir fizikiniais virsmais. Ji apima tokių dydžių kaip entalpija, entropija, laisvoji energija ir kalorijos skaičiavimus bei praktinius matavimus kalorimetruose. Aiškus supratimas apie energijos tėkmę leidžia numatyti reakcijų palankumą, optimizuoti procesus ir taikyti žinias pramonėje, energetikoje ir moksle.
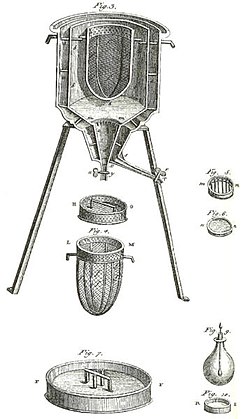
Pirmasis pasaulyje ledo kalorimetras, kurį 1782-1983 m. žiemą naudojo Antuanas Lavuazjė ir Pjeras Simonas Laplasas. Jis buvo naudojamas siekiant nustatyti šilumą, išsiskiriančią vykstant įvairiems cheminiams pokyčiams. Šie skaičiavimai buvo grindžiami ankstesniu Josepho Blacko latentinės šilumos atradimu. Šiais eksperimentais pradėta termochemija.
Istorija
Termochemija prasidėjo nuo dviejų idėjų:
- Lavoazjė ir Laplaso dėsnis (1780 m.): Lavaiso ir Laaulezio teiginiai: bet kokio virsmo energijos pokytis yra lygus ir priešingas energijos pokyčiui atvirkštinio proceso metu.
- Hesso įstatymas (1840 m.): Hessas: "Energijos pokytis bet kokio virsmo metu yra toks pat, nesvarbu, ar jis vyksta vienu, ar keliais etapais.
Šie atradimai buvo padaryti anksčiau nei pirmasis termodinamikos dėsnis (1845 m.). Jie padėjo mokslininkams suprasti šį dėsnį.
Edvardas Diazas ir Hessas tyrė savitąją šilumą ir slaptąją šilumą. Josephas Blackas sukūrė latentinės energijos pokyčių koncepciją.
1858 m. Gustavas Kirchhoffas parodė, kad reakcijos šilumos pokytį nusako produktų ir reaguojančių medžiagų šiluminės talpos skirtumas: ∂ Δ H ∂ T = Δ C p {\displaystyle {{\partial \Delta H} \per \dalinis T}=\Delta C_{p}} 
Kalorimetrija
Šilumos pokyčių matavimas vadinamas kalorimetrija. Juo matuojama cheminių reakcijų arba fizikinių pokyčių šiluma. Kalorimetras, kalorimetrijos prietaisas, paprastai yra uždara kamera.
Kalorimetrija atliekama šiais etapais: Chemikai pasirūpina, kad pokytis įvyktų kameroje. Temperatūra kameroje matuojama termometru arba termopora. Temperatūra nustatoma priklausomai nuo laiko ir gaunamas grafikas. Chemikai naudoja grafiką pagrindiniams dydžiams apskaičiuoti.
Šiuolaikiniai kalorimetrai turi mažus kompiuterius, kurie matuoja temperatūrą ir greitai pateikia apskaičiuotus duomenis. Vienas iš pavyzdžių - diferencinio skenavimo kalorimetras (DSC).
Sistemos
Termochemijoje labai naudingi keli termodinaminiai apibrėžimai. "Sistema" - tai konkreti visatos dalis, kuri yra tiriama. Visa, kas yra už sistemos ribų, laikoma aplinka arba aplinka. Sistema gali būti:
- izoliuota sistema - kai ji negali keistis energija ar medžiaga su aplinka, pavyzdžiui, izoliuotas bombos kalorimetras;
- uždara sistema - kai su aplinka galima keistis energija, bet ne materija, pavyzdžiui, garo radiatorius;
- atvira sistema - kai ji gali keistis medžiaga ir energija su aplinka, pavyzdžiui, puodu su verdančiu vandeniu.
Procesai
Sistema patiria "procesą", kai pasikeičia viena ar daugiau jos savybių (charakteristikų). Procesas susijęs (susijęs) su būsenos pokyčiu. Izoterminis (tos pačios temperatūros) procesas vyksta, kai sistemos temperatūra išlieka ta pati. Izobarinis (to paties slėgio) procesas vyksta, kai sistemos slėgis išlieka toks pat. Adiabatinis (be šilumos mainų) procesas vyksta tada, kai šiluma nejuda.
Susiję puslapiai
- Svarbios termochemijos publikacijos
- Izodezinė reakcija
- Maksimalaus darbo principas
- Reakcijos kalorimetras
- Thomsen-Berthelot principas
- Julius Thomsen
- Grynųjų medžiagų termodinaminės duomenų bazės
- Kalorimetrija
- Šilumos fizika
Klausimai ir atsakymai
K: Kas yra termochemija?
A: Termochemija - tai mokslas apie energiją ir šilumą, susijusią su cheminėmis reakcijomis ir fizikiniais virsmai.
K: Kokie yra fizikinių virsmų pavyzdžiai?
Atsakymas: Fizikinių virsmų pavyzdžiai yra lydymasis (kai kieta medžiaga virsta skysčiu) ir virimas (kai skystis virsta skysčiu).
K: Kaip termochemija padeda numatyti reagentų ir produktų kiekius?
A: Termochemikai naudoja duomenis, įskaitant entropijos nustatymus, kad numatytų reagentų ir produktų kiekius bet kuriuo konkrečios reakcijos metu.
K: Ar endoterminės reakcijos yra palankios, ar nepalankios?
A: Endoterminės reakcijos yra nepalankios.
K: Ar egzoterminės reakcijos yra palankios, ar nepalankios?
A: Egzoterminės reakcijos yra palankios.
K: Kokias sąvokas jungia termochemija?
A: Termochemija sujungia termodinamikos sąvokas su cheminių ryšių energijos idėja.
K: Kokius skaičiavimus atlieka termochemikai?
A: Termochemikai atlieka tokius skaičiavimus kaip šiluminė talpa, degimo šiluma, susidarymo šiluma, entalpija, entropija, laisvoji energija ir kalorijos.
Ieškoti