Karbokationas — apibrėžimas, struktūra, hibridizacija ir reaktyvumas
Karbokationas — apibrėžimas, struktūra, hibridizacija ir reaktyvumas: aiškus, iliustruotas paaiškinimas su stabilumo ir reakcijų mechanizmų analize chemijos studentams.
Karbokationas yra jonas su teigiamai įkrautu anglies atomu. Karbokationo anglies atomo krūvis apibūdinamas kaip „sekstetas“ — t. y. jo išoriniame valentiniame apvalkale vietoj aštuonių valentinių elektronų yra tik šeši elektronai. Anglies atomai su aštuoniais valentiniais elektronais pasižymi didžiausiu stabilumu pagal okteto taisyklę, todėl karbokationai dažnai yra reaktyvūs: jie siekia užpildyti valentinių elektronų oktetą ir atgauti neutralų krūvį.
Struktūra ir hibridizacija
Nors paprasta logika gali manyti, kad karbokationas turi sp3 hibridizaciją (tuščia sp3 orbitalė nešioja teigiamą krūvį), dauguma karbokationų iš tikrųjų elgiasi kaip sp2 hibridizuotos rūšys. Praktika rodo, kad karbokationai dažnai turi trigonalinę plokščią molekulinę geometriją: anglies atomas yra sp2 hibridizuotas, o tuščia (neužimta) p-orbitalė stovi statmenai šiai plokštumai. Tuščia p-orbitalė priima elektronų tankį per rezonansą ar hiperkonjuguotą sąveiką, tad tai lemia jų elgseną ir reaktyvumą.
Stabilumo veiksniai
- Alkilinės grupės (hiperkonjuguotė ir indukcija): alkilinės substituentės stabilizuoja karbokationą perduodamos elektronų tankį per hiperkonjuguotę (C–H/C–C jungčių sinergija) ir per indukcinius efektus. Todėl stabilumo eilė paprastai yra: tert > sec > prim > metilo.
- Rezonavimas: allyliniai ir benzylių karbokationai yra ypač stabilūs, nes tuščia p-orbitalė gali delokalizuoti krūvį per π-sistemą.
- Elektronų traukos ir donorystė: elektronų donorinės grupės (pvz., -OR, -NR2) stabilizuos karbokationą, tuo tarpu elektroneigios grupės mažins stabilumą.
- Solventas ir kontrjonas: polinės terpės bei gerai disocijuojantys anijonai stabilizuoja laisvus karbokationus. Ypač stiprios rūgštys (pvz., „superrūgštys“) gali izoliuoti ir net ilgesniam laikui išlaikyti tam tikrus karbokationus.
- Spinai: dauguma izoliuotų karbokationų egzistuoja singletiniu, plokščiu sp2 variantu; tripletiniai karbokationai yra retesni ir reikalauja specifinių sąlygų.
Reaktyvumas ir dažniausios reakcijos
Karbokationai yra elektrofiliškos rūšys, todėl dažniausiai reaguoja su nukleofilais. Kai kurie svarbiausi procesai:
- SN1 reakcijos — heterolizinio skilimo metu susidarantys karbokationai yra pagrindiniai tarpiniai produktai; jų stabilumas lemia reakcijos greitį.
- E1 eliminacijos — karbokationas gali prarasti protoną, susidarant alkenui.
- Elektrofilinė adicija prie alkenų — pavyzdžiui, rūgštinė adicija, kur pirmiausia susidaro karbokationas, o vėliau jis yra nukleofilų prijungtas.
- Perėjimai ir perstūmimai — siekdami didesnio stabilumo, karbokationai dažnai patiria hydride shift (vandenilio perkėlimą) arba alkilo perstūmimą.
- Rezonansinis užfiksavimas — benzilinių ar alilinių karbokationų atveju krūvis delokalizuojamas per aromatinį arba alilciklinį sistemą, kas leidžia greitesnę ir selektyvesnę nukleofilų prijungimą.
Praktiniai pavyzdžiai ir sintezė
- Tirpstantys reagentai: SN1 ir Friedel–Crafts alkilinimo reakcijos vyksta per karbokationų tarpininkus.
- Alkenų prisijungimas prie H–X (pvz., HBr) vyksta per karbokationų tarpininkavimą; Markownikovo selektyvumas paaiškinamas stabiliausio karbokationo susidarymu.
- Karbokationų stabilizavimas leidžia atlikti savitus sintezės žingsnius, tačiau reikia atsižvelgti į galimas perstūmimo reakcijas, kurios pakeičia galutinį produktą.
Detekcija ir izoliacija
Nors dauguma karbokationų yra trumpalaikiai ir nenustatyti sąlygomis kambario temperatūroje, juos galima stebėti ir kartais izoliuoti naudojant:
- žemą temperatūrą + in situ NMR spektroskopiją,
- masės spektrometriją reaguojant,
- ypatingai stiprias rūgštis (pvz., „magic acid“) arba stabilizuojančius anijonus (pvz., karboraninius anijonus), kurios leidžia ilgiau egzistuoti tam tikriems karbokationams.
Santrauka
Karbokationai yra teigiamai įkrauti anglies jonai su seksteto elektronine konfigūracija, dažnai turintys sp2 hibridizaciją ir trigonalinę plokščią geometriją. Jų stabilumą lemia hiperkonjuguotė, rezonansas ir indukciniai efektai; stabiliausi yra tertiary, benzylic ir allylic karbokacionai. Dėl didelio elektrofiliškumo jie yra pagrindiniai tarpiniai produktai daugelio organinių reakcijų (SN1, E1, elektrofilinė adicija, Friedel–Crafts ir kt.), o jų elgsena — įskaitant perstūmimus ir nukleofilų prijungimą — lemia reakcijų selektyvumą ir galutinius produktus.
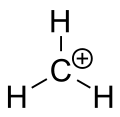
Metano karbeno jonas

terc-butilo katijonas, rodantis plokščią geometriją
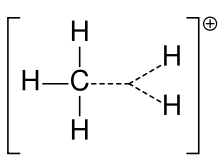
Metano karbonio jonas
Apibrėžtys
Anksčiau karbokatas dažnai buvo vadinamas karbonio jonu, tačiau chemikai abejoja dėl tikslios jo reikšmės. Dabartinėje chemijoje karbokatas yra bet koks teigiamai įkrautas anglies atomas. Siūlomi du specialūs tipai: karbenio jonai yra trivalentiai, o karbonio jonai - penkiavalentiai arba šešiavalentiai. Universitetinio lygio vadovėliuose apie karbokationus kalbama tik taip, tarsi jie būtų karbenijaus jonai, arba apie karbokationus kalbama su trumpalaike nuoroda į senesnį žodžių junginį karbonio jonas arba karbenijaus ir karbonio jonai. Viename vadovėlyje iki šiol karbenio jonas vadinamas senesniu karbenio jono pavadinimu, o frazė hipervalentinis karbenio jonas paliekama CH5+.
Istorija
1891 m. G. Merlingas pranešė, kad į tropilideną (cikloheptatrieną) pridėjęs bromo ir kaitindamas produktą gavo kristalinę, vandenyje tirpią medžiagą C
7H
7Br. Jis nenurodė jos struktūros, tačiau Doeringas ir Knoxas įtikinamai įrodė, kad tai yra tropileno (cikloheptatrienilo) bromidas. Pagal Hückelio taisyklę prognozuojama, kad šis jonas yra aromatinis.
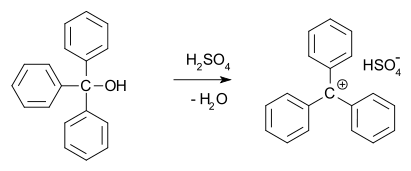
1902 m. Norrisas ir Kehrmanas nepriklausomai vienas nuo kito nustatė, kad bespalvis trifenilmetanolis koncentruotoje sieros rūgštyje duoda tamsiai geltonus tirpalus. Trifenilmetilchloridas panašiai sudarė oranžinius kompleksus su aliuminio ir alavo chloridais. 1902 m. Adolfas von Baeyeris pastebėjo, kad susidarę junginiai yra panašūs į druskas.
Spalvos ir druskų susidarymo ryšį jis pavadino halochromija, kurios geriausias pavyzdys yra žalias malachitas.
Karbokacijos yra reaktyvūs tarpiniai produktai daugelyje organinių reakcijų. Šią idėją, kurią 1899 m. pirmasis pasiūlė Julius Stieglitzas, toliau plėtojo Hansas Meerweinas, 1922 m. atlikęs Wagnerio-Meerweino pertvarkymo tyrimą. Taip pat nustatyta, kad karbokationai dalyvauja NS1 reakcijoje, E1 reakcijoje ir persitvarkymo reakcijose, pavyzdžiui, Whitmore'o 1,2 poslinkyje. Cheminės pramonės atstovai nenoriai pripažino karbokationo sąvoką ir ilgą laiką Amerikos chemikų draugijos žurnalas atsisakydavo skelbti straipsnius, kuriuose jie buvo minimi.
Pirmąjį NMR spektrą, kuriame matomas stabilus karbokatas tirpale, 1958 m. paskelbė Doeringas ir kt. Tai buvo heptametilbenzenio jonas, gautas apdorojant heksametilbenzeną metilo chloridu ir aliuminio chloridu. Stabilų 7-norbornadienilo katijoną 1960 m. paruošė Story ir kt. reaguodami norbornadienilo chloridą su sidabro tetrafluoroboratu sieros diokside -80 °C temperatūroje. Pagal NMR spektrą nustatyta, kad jis yra neklasikinis tiltelis (pirmasis stabilus neklasikinis jonas).
1962 m. Olahas branduolinio magnetinio rezonanso metodu tiesiogiai pastebėjo terc-butilo karbokationą kaip stabilią rūšį, ištirpinus terc-butilfluoridą maginėje rūgštyje. Apie norbornylo katijono NMR pirmą kartą pranešė Schleyer ir kt., o Saunders ir kt. parodė, kad jis patiria protonų skilimą per barjerą.
Savybės
Organinėje chemijoje karbokatorius dažnai yra nukleofilų, pavyzdžiui, hidroksilo (OH−) jonų arba halogeno jonų, nukleofilinės atakos taikinys.
Karbokacijos skirstomos į pirmines, antrines arba tretines, priklausomai nuo anglies atomų, prisijungusių prie jonizuotos anglies, skaičiaus. Pirminiai karbocationai turi vieną arba nulį anglies atomų, prijungtų prie jonizuotos anglies, antriniai karbocationai turi du anglies atomus, prijungtus prie jonizuotos anglies, o tretiniai karbocationai turi tris anglies atomus, prijungtus prie jonizuotos anglies.
Karbokatono stabilumas didėja, kai prie krūvį turinčios anglies prisijungia daugiau alkilo grupių. Tretiniai karbokationai yra stabilesni (ir lengviau susidaro) nei antriniai karbokationai; pirminiai karbokationai yra labai nestabilūs, nes jonizuoti aukštesnės eilės angliavandeniai stabilizuojami hiperkonjugacijos būdu, o nepakeisti (pirminiai) angliavandeniai - ne. Todėl tokios reakcijos kaip NS1 reakcija ir E1 eliminacijos reakcija paprastai nevyksta, jei susidaro pirminis karbokationas. Išimtis yra tada, kai šalia jonizuotos anglies yra dviguba anglies jungtis. Tokie katijonai kaip alilo katijonas CH=CH-CH22+ ir benzilo katijonas6 CH-CH52+ yra stabilesni už daugumą kitų karbokationų. Molekulės, galinčios sudaryti alilo arba benzilo karbokationus, yra ypač reaktyvios.
Karbokatijonai persitvarko iš mažiau stabilių struktūrų į tokias pat stabilias arba stabilesnes, o greičio konstantos viršija 10 sek9. Šis faktas apsunkina daugelio junginių sintezės kelius. Pavyzdžiui, kaitinant 3-pentanolį su vandeniniu HCl, iš pradžių susidaręs 3-pentilo karbokatas persitvarko į statistinį 3-pentilo ir 2-pentilo mišinį. Šie katijonai reaguoja su chlorido jonu ir susidaro maždaug 1/3 3-chlorpentano ir 2/3 2-chlorpentano.
Kai kurie karbokatijonai, pavyzdžiui, norbornilo katijonas, pasižymi daugiau ar mažiau simetrišku trijų centrų ryšiu. Tokie katijonai vadinami neklasikiniais jonais. Energijos skirtumas tarp "klasikinių" ir "neklasikinių" karbokationų ir izomerų dažnai yra labai mažas, o perėjimo tarp "klasikinių" ir "neklasikinių" struktūrų aktyvacijos energija paprastai būna nedidelė, jei iš viso būna. "Neklasikinė" 2butilo karbokationo forma iš esmės yra 2-butenas, kurio protonas yra tiesiai virš dvigubos anglies ir anglies jungties centro. Kadaise dėl "neklasikinių" karbokacijų kilo daug ginčų. Vienas didžiausių Džordžo Olos indėlių į chemiją buvo šio ginčo sprendimas.
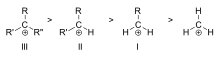
Tretinio (III), antrinio (II) ir pirminio (I) alkilo karbokationų pavyzdžių stabilumo tvarka
Specifiniai karbokationai
Ciklopropilkarbinilo katijonus galima tirti NMR metodu:
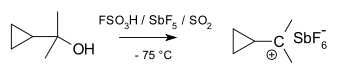
Dimetilo darinio NMR spektre du neekvivalentiški signalai dviem metilo grupėms rodo, kad šio katijono molekulinė konformacija yra ne statmena (kaip A), o dvilypė (kaip B), kai tuščia p-orbitalė ir ciklopropilo žiedo sistema yra toje pačioje plokštumoje:
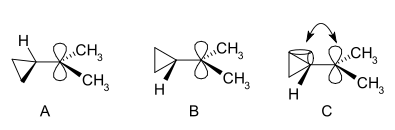
Remiantis lenktųjų ryšių teorija, ši pirmenybė paaiškinama darant prielaidą, kad užpildytų ciklopropano lenktųjų ryšių ir tuščios p-orbitalės orbitalės sutampa.
Klausimai ir atsakymai
K: Kas yra karbokationas?
A: Karbokatas yra jonas su teigiamai įkrautu anglies atomu.
K: Koks yra išorinis karbokationo valentinis apvalkalas?
A: Išorinis karbokationo valentinis apvalkalas turi tik šešis elektronus vietoj stabilių aštuonių valentinių elektronų.
K: Kodėl karbokationai dažnai būna reaktyvūs?
A: Karbokatacijos dažnai būna reaktyvios, nes siekia užpildyti valentinių elektronų oktetą ir atgauti neutralų krūvį.
K: Koks yra didžiausias anglies atomų stabilumas?
A: Didžiausias anglies atomų stabilumas pasiekiamas, kai jie turi aštuonis valentinius elektronus.
K: Kas chemijoje yra sekstetas?
A: Sekstetas - tai terminas, vartojamas apibūdinti anglies atomui, esančiam karbokate, kurio išoriniame valentiniame apvalkale vietoj stabilių aštuonių valentinių elektronų yra tik šeši elektronai.
K: Kokia yra karbokationo hibridizacija ir molekulinė geometrija?
Atsakymas: Nors logika rodo, kad karbokationai turi sp3 hibridizaciją, o tuščia sp3 orbitalė suteikia teigiamą krūvį, jų reaktyvumas labiau primena sp2 hibridizaciją su trigonine plokščia molekuline geometrija.
K: Kas yra okteto taisyklė?
A: Okteto taisyklė yra chemijos principas, kuris teigia, kad atomai linkę sudaryti cheminius ryšius su kitais atomais, kurie leidžia abiem atomams turėti stabilų aštuonių valentinių elektronų rinkinį.
Ieškoti