SN2 reakcija: apibrėžimas, mechanizmas ir pavyzdžiai
SN2 reakcija: aiškus apibrėžimas, žingsnis po žingsnio mechanizmas ir praktiniai pavyzdžiai organinėje chemijoje — sužinokite, kaip veikia bimolekulinė nukleofilinė substitucija.
SN 2 reakcija (dar vadinama bimolekuline nukleofiline substitucija) yra organinės chemijos substitucijos reakcija. Tai nukleofilinės pakaitos rūšis, kai nukleofilo vieniša pora atakuoja elektrono trūkumo elektrofilinį centrą ir su juo susijungia, o priešingai orientuota išeinanti grupė — "išeinanti grupe" — vienu žingsniu išstumiamą. Kadangi lėtame, greitį lemiančiame reakcijos etape dalyvauja dvi reaguojančios rūšys (nukleofilas ir substratas), reakcija vadinama bimolekuline nukleofiline substitucija arba SN2.
Mechanizmas
SN2 yra koncertinė (vieno žingsnio) reakcija: nukleofilas atakuoja nuo substrato priešingos pusės (backside attack), susidaro tranzicinis pentakoordinuotas kompleksas (dalinis junginys), ir išeinanti grupė yra išstumta tuo pačiu metu. Dėl tokios atakos dažnai vyksta Waldeno inversija — stereocentras invertuojasi (pvz., iš R į S konfigūraciją).
Greitis ir kinetika
- SN2 reakcijos greitis apibūdinamas įstatymu: rate = k [nukleofilas][substratas]. Todėl greitis priklauso nuo abiejų reaguojančių rūšių koncentracijų.
- Perėjimo būsena yra energetiškai didesnė už reagėntus — reakcijos energijos profilis turi vieną energijos barjerą (vieno etapo mechanizmas).
Faktoriai, lemiantys SN2 reakciją
- Substrato struktūra: steriškai neužstoti centrai skatina SN2. Tipinė tvarka: metilo > pirminis > antrinis. Terciniai alkilai praktiškai nepatiria SN2 dėl sterinio užstojimo.
- Nukleofilas: stiprus, neperprotonuotas nukleofilas (didelis atominis krūvis, maža elektrono delokalizacija) pagreitina SN2. Pavyzdžiui, OH-, RS-, CN- yra geri nukleofilai.
- Išeinanti grupė: geros išeinančios grupės stabilizuoja negatyvų krūvį ir palengvina išstūmimą. Pavyzdžiui, I- > Br- > Cl-; tosilo grupė (OTs) yra dar geresnė išeinanti grupė.
- Tirpiklis: SN2 dažniau vyksta poliariniuose aprotinėse tirpikliuose (pvz., DMSO, DMF, acetonas), nes jie mažiau solvatuoja anijonus ir leidžia nukleofilui būti reaktyvesniam. Poliariniai protiniai tirpikliai (pvz., vanduo, alkoholiai) solvatuoja nukleofilus ir lėtina SN2.
- Temperatūra ir koncentracijos: didesnė temperatūra paprastai pagreitina reakciją; didesnės reaktantų koncentracijos didina greitį pagal kinetikos lygtį.
Stereochemija
Tipiška SN2 reakcijos savybė – inversija (Waldeno inversija) dėl nukleofilo atakos iš priešingos pusės. Jei substratas turi stereocentrą, produktas paprastai turi priešingą konfigūraciją.
Pavyzdžiai
- Alkilhalidų nukleofilinė pakaita: CH3CH2Br + OH- → CH3CH2OH + Br- (etilo bromidas pakeičiamas hidroksilo grupe).
- Williamsono eterio sintezė: R–X + R'O- → R–O–R' + X- (alkilhalidas reaguoja su alkoksidu — klasikinis SN2 pavyzdys, dažnai su pirminiais alkilhalidais).
- Finkelšteino reakcija: R–Cl + NaI (acetone) → R–I + NaCl — halido mainai, vykstantys SN2 mechanizmu (acetonas kaip aprotinis tirpiklis skatina reakciją).
Kitos pastabos ir konkurencija su kitais mechanizmais
- Antriniai centrai gali reaguoti tiek per SN2, tiek per SN1, priklausomai nuo sąlygų (tirpiklis, nukleofilas, temperatūra). Stiprūs baziniai/nukleofilai ir aprotiniai tirpikliai skatina SN2; poliarūs protiniai tirpikliai ir stabilus karbokationas skatina SN1.
- Esant stipriam, steriškai negalimai nukleofilui ir esant β-vietoms vandeniliams, gali vykti E2 eliminacija vietoje pakaitos.
- Svarbu eksperimentiniuose darbo laukuose atsižvelgti į temperatūrą, tirpiklio pasirinkimą ir išeinančios grupės pobūdį, kad būtų pasiektas pageidaujamas mechanizmas ir aukštas selektyvumas.
Apibendrinant: SN2 yra vieno žingsnio, bimolekulinė nukleofilinė substitucija, kuri reikalauja atviros prieigos nukleofilui prie reaktyvaus centro, turi charakteringą stereochimiką (inversiją) ir yra jautri substrato struktūrai, nukleofilui, išeinančiai grupei bei tirpikliui.
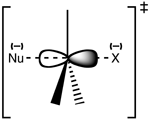
SN 2 pereinamosios būsenos struktūra
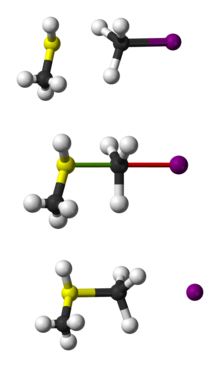
SN 2 CH3 SH reakcijos su CH3 I rutulinis ir lazdelinis vaizdas
Reakcijos mechanizmas
Reakcija dažniausiai vyksta alifatiniame sp3 anglies centre, prie kurio prijungta elektroneigiama, stabili palikimo grupė - "X" - dažnai halogenido atomas. C-X ryšys nutrūksta ir naujas C-Nu ryšys susidaro vienu metu, ir susidaro pereinamoji būsena, kurioje nukleofilo atakuojama anglis yra penkiakoordinatinė ir maždaug sp2 hibridizuota. Nukleofilas atakuoja anglį, esančią 180° kampu palikimo grupės atžvilgiu, nes taip nukleofilo vienišoji pora ir C-X σ* antivaržos orbitalė geriausiai sutampa. Tada paliekančioji grupė išstumiama iš priešingos pusės ir susidaro produktas.
Jei nukleofiliniu būdu atakuojamas substratas yra chiralinis, tai gali lemti, nors ir nebūtinai, stereochemijos inversiją, vadinamą Waldeno inversija.
SN 2 reakcijos pavyzdys: OH −(nukleofilas) atakuoja bromoetaną (elektrofilas), todėl susidaro etanolis, o bromidas išsiskiria kaip išeinanti grupė:
SN 2 reakcija įvyksta, jei atakos iš galinės pusės kelio neblokuoja kiti molekulės atomai (steriliai trukdo substituentai ant substrato). Taigi, šis mechanizmas paprastai vyksta ties netrukdomu pirminiu anglies centru. Jei substratas yra steriškai užstotas netoli paliekančiosios grupės, pavyzdžiui, ties tretinės anglies centru, substitucija vyks pagal SN 1, o ne pagal SN 2 mechanizmą (SN 1 taip pat būtų labiau tikėtinas, jei molekulės būtų užblokuotos, nes galėtų susidaryti pakankamai stabilus tarpinis karbokatas).
Koordinacinėje chemijoje asociatyvusis pakeitimas vyksta pagal panašų mechanizmą kaip SN 2.
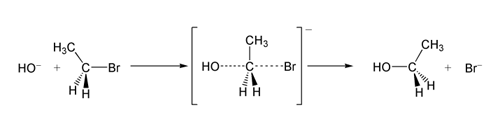
SN 2 bromoetano reakcija su hidroksido jonu.
Reakcijos greitį veikiantys veiksniai
Reakcijos greičiui įtakos turi keturi veiksniai:
- Substratas. Substratas atlieka svarbiausią vaidmenį nustatant reakcijos greitį. Taip yra todėl, kad nukleofilas atakuoja substratą iš jo galo, taip nutraukdamas anglies ir nukleofilo jungtį ir sudarydamas anglies ir nukleofilo jungtį. Todėl, norint padidinti SN 2 reakcijos greitį, substrato nugarėlė turi būti kuo mažiau kliudoma. Apskritai tai reiškia, kad greičiausiai reaguoja metilo ir pirminiai substratai, po jų - antriniai substratai. Tretiniai substratai nedalyvauja SN 2 reakcijose dėl sterinių kliūčių.
- Nukleofilas. Kaip ir substratas, steriniai trukdžiai turi įtakos nukleofilo stiprumui. Pavyzdžiui, metoksido anijonas yra ir stipri bazė, ir nukleofilas, nes jis yra metilo nukleofilas, todėl jam nėra jokių kliūčių. Kita vertus, tert-butoksidas yra stipri bazė, bet silpnas nukleofilas, nes trys metilo grupės trukdo jam priartėti prie anglies. Nukleofilo stiprumui taip pat turi įtakos krūvis ir elektroneigiamumas: nukleofiliškumas didėja didėjant neigiamam krūviui ir mažėjant elektroneigiamumui. Pavyzdžiui, OH- yra geresnis nukleofilas nei vanduo, o I- yra geresnis nukleofilas nei Br- (poliniuose protiniuose tirpikliuose). Poliariniame aprotiniame tirpiklyje nukleofiliškumas didėja periodinės lentelės stulpeliu aukštyn, nes tarp tirpiklio ir nukleofilo nėra vandenilinio ryšio. Šiuo atveju nukleofiliškumas atspindi baziškumą. Todėl I- būtų silpnesnis nukleofilas nei Br- , nes jis yra silpnesnė bazė.
- Tirpiklis. Tirpiklis turi įtakos reakcijos greičiui, nes tirpikliai gali supti arba nesupti nukleofilą, taip trukdydami arba netrukdydami jam priartėti prie anglies atomo. Poliniai aprotiniai tirpikliai, pavyzdžiui, tetrahidrofuranas, yra geresni tirpikliai šiai reakcijai nei poliniai protiniai tirpikliai, nes poliniai protiniai tirpikliai bus tirpinami tirpiklio vandeniliniu ryšiu su nukleofilu. Tai trukdo jam atakuoti anglį su paliekamąja grupe.
- Išvykimo grupė. Paliekančioji grupė turi įtakos reakcijos greičiui. Kuo stabilesnė paliekančioji grupė, tuo didesnė tikimybė, kad nukleofilui atakuojant anglį, ji pasiims du elektronus, esančius jos anglies jungtyje. Todėl kuo silpnesnė paliekančioji grupė yra konjuguota bazė, tuo geresnė paliekančioji grupė. Panašiai, kuo stipresnė ją atitinkanti rūgštis, tuo geresnė paliekamoji grupė. Gerų paliekančiųjų grupių pavyzdžiai yra halogenidai (išskyrus fluoridą) ir tozilatas. Tačiau HO- ir H2 N- nėra geros palikimo grupės.
Reakcijos kinetika
SN 2 reakcijos greitis yra antros eilės, nes greitį lemiantis etapas priklauso nuo nukleofilo koncentracijos [Nu− ] ir substrato koncentracijos [RX].
r = k[RX][Nu− ]
Tai yra esminis SN 1 ir SN 2 mechanizmų skirtumas. SN 1 reakcijos metu nukleofilas atakuoja jau pasibaigus greitį ribojančiam etapui. Tačiau SN 2 reakcijos metu nukleofilas išstumia paliekamąją grupę ribojančioje stadijoje. Kitaip tariant, SN 1 reakcijos greitis priklauso tik nuo substrato koncentracijos, o SN 2 reakcijos greitis priklauso ir nuo substrato, ir nuo nukleofilo koncentracijos. Tais atvejais, kai galimi abu mechanizmai (pavyzdžiui, antrinio anglies centro), mechanizmas priklauso nuo tirpiklio, temperatūros, nukleofilo koncentracijos arba nuo paliekančiosios grupės.
SN 2 reakcijoms paprastai pirmenybė teikiama pirminiams alkilo halogenidams arba antriniams alkilo halogenidams su aprotiniu tirpikliu. Tretiniuose alkilhalogeniduose dėl sterinių kliūčių jos vyksta nežymiai.
SN 2 ir SN 1 yra du slankiosios reakcijų skalės kraštutinumai. Galima rasti daug reakcijų, kurių mechanizmuose pasireiškia ir SN 2, ir SN 1 pobūdis. Pavyzdžiui, galima gauti iš alkilo halogenido susidariusią kontaktinę jonų porą, kurioje jonai nėra visiškai atskirti. Kai jie pakeičiami, daugelio reaguojančių molekulių stereochemija bus apversta (kaip ir SN 2 atveju), tačiau kelios iš jų gali išlaikyti konfigūraciją. SN 2 reakcijos yra dažnesnės nei SN 1 reakcijos.
E2 konkursas
Dažna šalutinė reakcija, vykstanti su SN 2 reakcijomis, yra E2 eliminacija: įeinantis anijonas gali veikti kaip bazė, o ne kaip nukleofilas, pašalindamas protoną ir sudarydamas alkeną. Šį efektą galima parodyti dujų fazėje vykstančioje sulfonato ir paprasto alkilbromido reakcijoje, vykstančioje masės spektrometre:

Su etilo bromidu reakcijos produktas yra daugiausia pakaitos produktas. Didėjant steriniams trukdžiams aplink elektrofilinį centrą, kaip izobutilo bromido atveju, substitucija yra nepalanki ir vyraujanti reakcija yra eliminacija. Kiti eliminacijai palankūs veiksniai yra bazės stiprumas. Su mažiau baziniu benzoato substratu izopropilo bromidas reaguoja 55 % pakaitinimo būdu. Apskritai šio tipo dujų fazės reakcijos ir tirpalo fazės reakcijos vyksta pagal tas pačias tendencijas, nors pirmojoje reakcijoje tirpiklio poveikis išnyksta.
Apskritojo kelio mechanizmas
2008 m. dėmesio sulaukė naujovė, susijusi su SN 2 apvaliuoju mechanizmu, pastebėtu dujinės fazės reakcijoje tarp chlorido jonų ir metiljodido, naudojant specialų metodą, vadinamą kryžminio molekulinio pluošto vaizdavimu. Kai chlorido jonų greitis yra pakankamas, po susidūrimo susidariusių jodido jonų energija yra daug mažesnė, nei tikėtasi, ir teoriškai manoma, kad energija prarandama dėl visiško metilo grupės apsisukimo aplink jodo atomą prieš įvykstant tikrajam poslinkiui.
Susiję puslapiai
- Pakeitimo reakcija
- SN 1 reakcija
Klausimai ir atsakymai
K: Kas yra SN2 reakcija?
A: SN2 reakcija yra organinės chemijos pakaitos reakcija, kai nukleofilas atakuoja elektrono trūkumo elektrofilinį centrą, išstumdamas paliekamąją grupę ir vienu žingsniu ją pakeisdamas.
K: Kokios rūšies pakaitos reakcija yra SN2 reakcija?
A: SN2 reakcija yra nukleofilinės pakaitos reakcijos rūšis.
K: Kiek reaguojančių rūšių dalyvauja lėtoje, greitį lemiančioje SN2 reakcijos stadijoje?
Atsakymas: SN2 reakcijos lėtame, greitį lemiančiame etape dalyvauja dvi reaguojančios rūšys.
K: Ką reiškia SN2 reakcijos pavadinimas "bimolekulinė nukleofilinė substitucija"?
A: SN2 reakcijos pavadinimas "bimolekulinė nukleofilinė substitucija" reiškia, kad lėtame, greitį lemiančiame reakcijos etape dalyvauja dvi reaguojančios rūšys.
K: Kas yra nukleofilas SN2 reakcijos kontekste?
A: Nukleofilas yra molekulė arba jonas, kuris atiduoda vienišą elektronų porą, kad susidarytų cheminis ryšys.
K: Kas yra elektrofilas SN2 reakcijoje?
A: Elektrofilas yra molekulė arba jonas, kuris priima elektronų porą ir sudaro cheminę jungtį.
K: Kaip neorganinės chemijos specialistai dažnai vadina SN2 reakciją?
A: Neorganinės chemijos specialistai SN2 reakciją dažnai vadina mainų mechanizmu.
Ieškoti